中國蘇州和美國馬里蘭州羅克維爾市2021年1月14日—致力于在腫瘤��、乙肝及與衰老相關(guān)疾病等治療領(lǐng)域開(kāi)發(fā)創(chuàng )新藥物的處于臨床階段的研發(fā)企業(yè)-- 亞盛醫藥(6855.HK)于北京時(shí)間1月13日晚間出席第39屆摩根大通醫療(線(xiàn)上)官方會(huì )議��。亞盛醫藥董事長(cháng)�����、CEO楊大俊博士代表公司匯報近期多項進(jìn)展�����,全球創(chuàng )新價(jià)值凸顯����。
全球創(chuàng )新進(jìn)展頻頻
楊大俊博士就公司研發(fā)管線(xiàn)與近期業(yè)務(wù)進(jìn)展作了精彩報告��。作為全球領(lǐng)先的蛋白-蛋白相互作用靶點(diǎn)藥物研發(fā)公司�����,公司擁有極具國際競爭力的產(chǎn)品管線(xiàn)�,在研項目多具有全球性“first-in-class”或“best-in-class”潛力(見(jiàn)表1)���。目前亞盛醫藥已獲得臨床批件33項�����,正在全球層面開(kāi)展40多項臨床研究���。
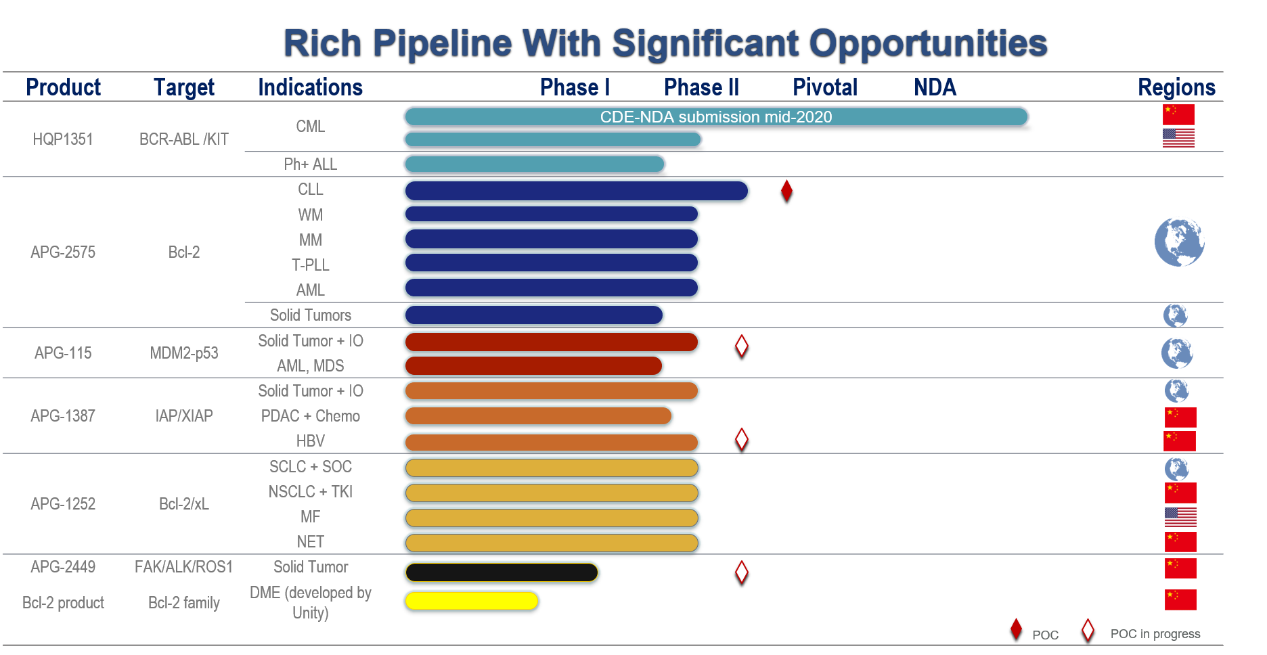
表1 公司主要產(chǎn)品管線(xiàn)圖
楊大俊博士特別總結了公司2020年在新冠疫情的挑戰下依舊取得的眾多里程碑式進(jìn)展:
Bcl-2抑制劑APG-2575呈現明顯優(yōu)勢與潛力
作為全球領(lǐng)先的細胞凋亡通路新藥研發(fā)公司�����,亞盛醫藥在該領(lǐng)域已構建豐富的品種布局��,并針對Bcl-2�����、IAP 及MDM2-p53 三條關(guān)鍵細胞凋亡路徑推進(jìn)5個(gè)在研品種進(jìn)入臨床階段��。其中APG-2575為公司自主研發(fā)的新型口服Bcl-2選擇性小分子抑制劑����,是全球層面繼Venetoclax之后罕有的進(jìn)入臨床開(kāi)發(fā)階段的Bcl-2選擇性抑制劑�,也是首個(gè)在中國進(jìn)入臨床階段的���、本土研發(fā)的Bcl-2選擇性抑制劑����,備受關(guān)注�。
2020年12月�����,公司已公布APG-2575的最新臨床進(jìn)展:針對復發(fā)/難治CLL的臨床研究已入組30多位患者�����,初步臨床研究結果顯示���,在可評估患者中的客觀(guān)緩解率(ORR)達到70%�����。這一數據非常令人振奮�����。在本次摩根大通會(huì )議上�,楊大俊博士進(jìn)一步展示了相關(guān)數據��。
特別是在A(yíng)PG-2575的有效性方面�����,楊大俊博士強調了兩點(diǎn)���,一是在重要的有效性指標淋巴細胞絕對數(ALC)方面��,3位高風(fēng)險的入組患者在接受一個(gè)周期的治療之后�,ALC指標已經(jīng)恢復正常的水平(見(jiàn)圖1)�����;二是在相較基線(xiàn)的淋巴結體積方面��,可評估患者的變化非常明顯 (見(jiàn)圖2)��。
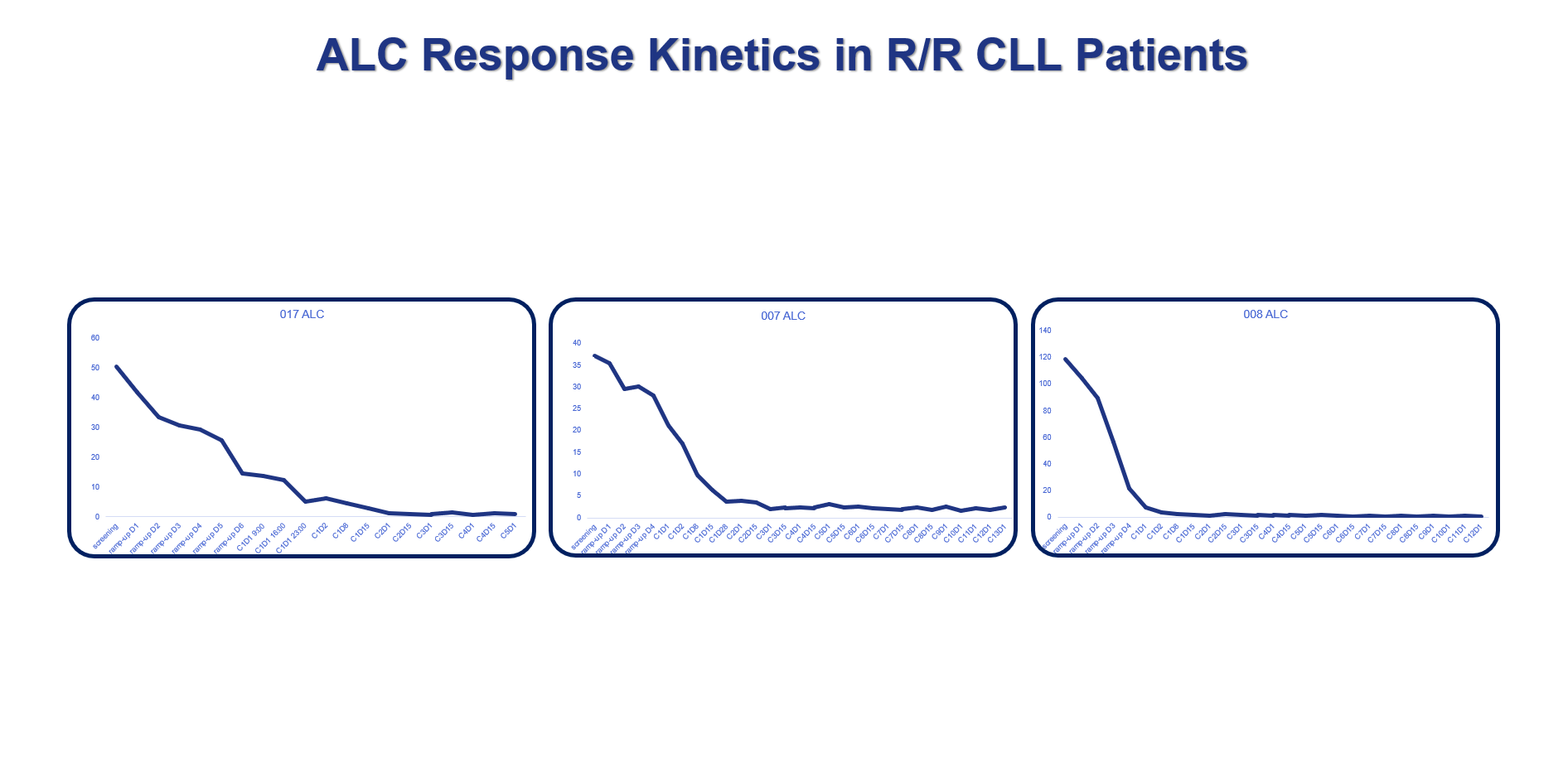
圖1
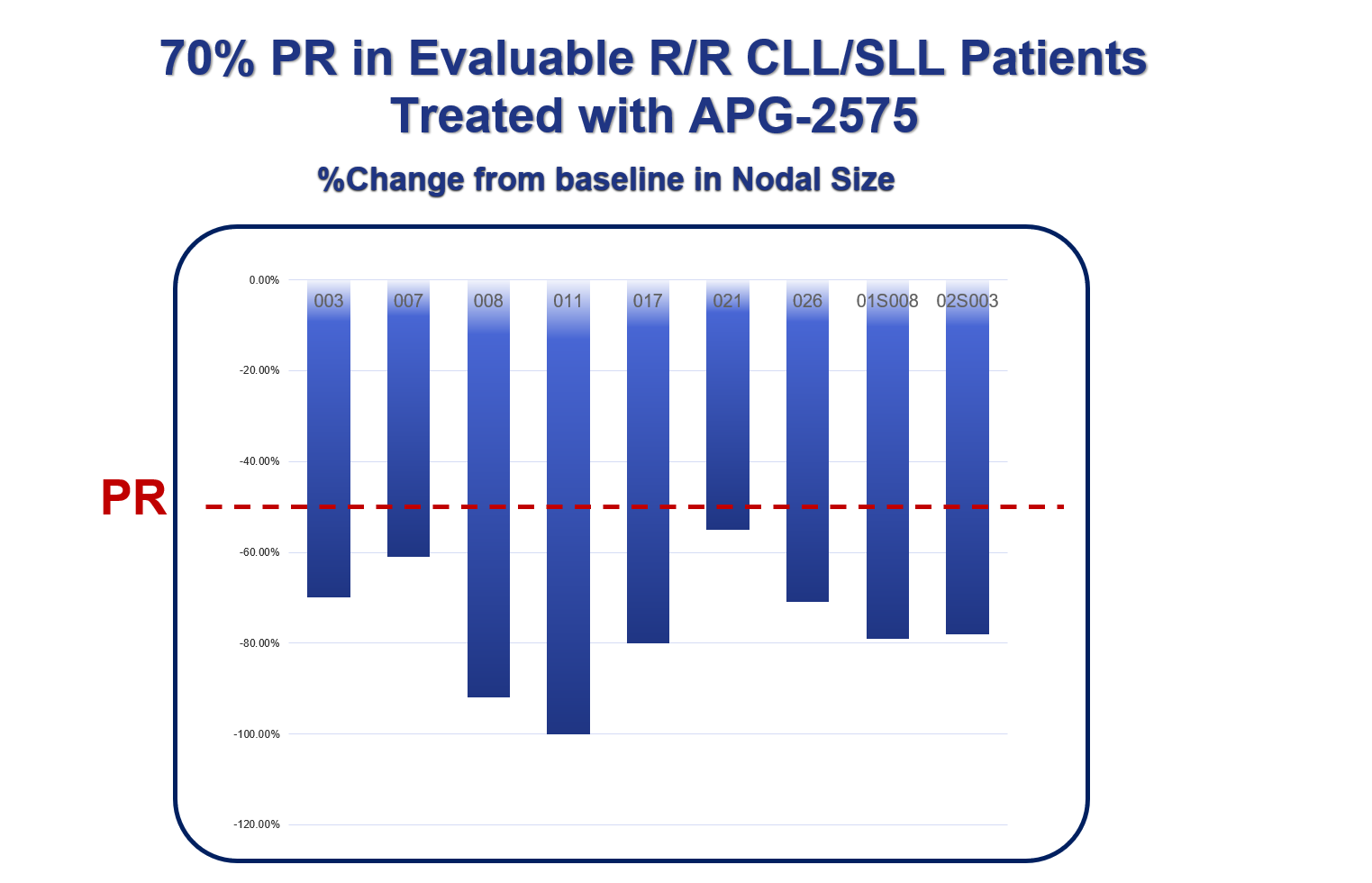
圖2
Figure 2
同時(shí)����,楊大俊博士還指出����,臨床前數據顯示�,APG-2575在BTK耐藥���、Venetoclax 無(wú)效的WM PDX模型中顯示良好的抑制腫瘤效果(見(jiàn)圖3)�����。這為APG-2575臨床適應癥的進(jìn)一步探索提供了基礎���,顯示較大潛力����。
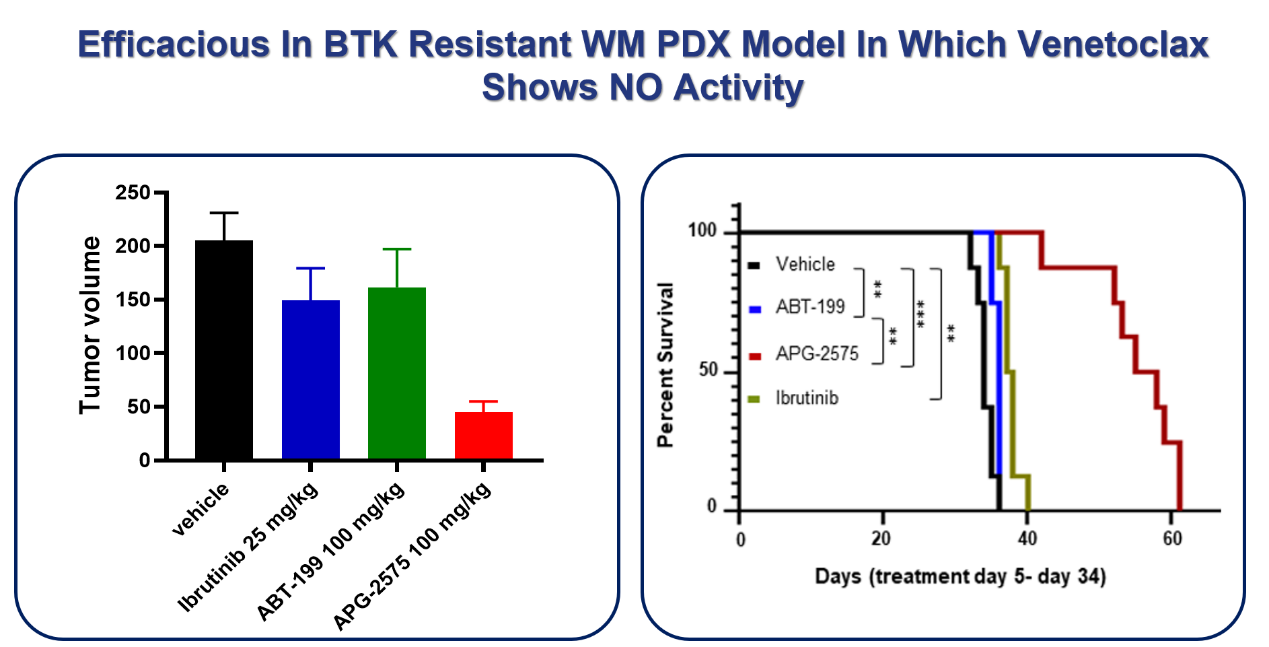
圖3
楊大俊博士表示:很高興能受邀參加本屆摩根大通醫療大會(huì )�����,與全球的醫藥投資者分享我們的近期進(jìn)展�。整體而言����,在全球新冠疫情的挑戰下����,亞盛在2020年仍獲得多項里程碑進(jìn)展����,我們的“全球創(chuàng )新”的戰略效應逐步顯現��。我們將繼續堅持這一戰略�,加快全球層面的臨床開(kāi)發(fā)���,進(jìn)一步壘實(shí)公司在細胞凋亡新藥研發(fā)的領(lǐng)先地位���,并早日將產(chǎn)品推向上市���?���!?/span>
關(guān)于亞盛醫藥
亞盛醫藥是一家立足中國�����、面向全球的處于臨床開(kāi)發(fā)階段的原創(chuàng )新藥研發(fā)企業(yè)�,致力于在腫瘤�����、乙肝及與衰老相關(guān)的疾病等治療領(lǐng)域開(kāi)發(fā)創(chuàng )新藥物�����。2019年10月28日�����,亞盛醫藥在香港聯(lián)交所主板掛牌上市�,股票代碼:6855.HK�����。
亞盛醫藥擁有自主構建的蛋白-蛋白相互作用靶向藥物設計平臺�����,處于細胞凋亡通路新藥研發(fā)的全球最前沿���。公司已建立擁有8個(gè)已進(jìn)入臨床開(kāi)發(fā)階段的1類(lèi)小分子新藥產(chǎn)品管線(xiàn)����,包括抑制Bcl-2��、IAP 或 MDM2-p53 等細胞凋亡路徑關(guān)鍵蛋白的抑制劑��;新一代針對癌癥治療中出現的激酶突變體的抑制劑等���,為全球唯一在細胞凋亡路徑關(guān)鍵蛋白領(lǐng)域均有臨床開(kāi)發(fā)品種的創(chuàng )新公司���。目前公司正在中國�����、美國及澳大利亞開(kāi)展40多項I/II期臨床試驗�����。用于治療耐藥性慢性髓性白血病的核心品種HQP1351已在中國遞交新藥上市申請����,該品種獲得了美國FDA審評快速通道及孤兒藥認證資格�。截至目前�����,公司共有4個(gè)在研新藥獲得9項FDA孤兒藥資格認證���。
前瞻性聲明
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關(guān)�����。除法律規定外���,于作出前瞻性陳述當日之后�����,無(wú)論是否出現新資料�����、未來(lái)事件或其他情況���,我們并無(wú)責任更新或公開(kāi)修改任何前瞻性陳述及預料之外的事件����。請細閱本文����,并理解我們的實(shí)際未來(lái)業(yè)績(jì)或表現可能與預期有重大差異����。本文內所有陳述乃本文章刊發(fā)日期作出����,可能因未來(lái)發(fā)展而出現變動(dòng)����。