根據港交所最新披露���,創(chuàng )勝集團?(Transcenta Holding)?已遞交IPO申請�,聯(lián)席保薦人為高盛和中金公司����。創(chuàng )勝集團是一家集發(fā)現��、研究�、開(kāi)發(fā)��、制造及業(yè)務(wù)拓展能力為一體的臨床階段全球生物醫藥公司��,其開(kāi)發(fā)管線(xiàn)已有9個(gè)新藥分子��,涵蓋腫瘤�����、骨科和腎病等領(lǐng)域�����。根據招股書(shū)����,本次IPO所募集資金將主要用于創(chuàng )勝集團管線(xiàn)候選產(chǎn)品的開(kāi)發(fā)和商業(yè)化����,并為擴充管線(xiàn)及開(kāi)發(fā)技術(shù)提供資金支持等��。

截圖來(lái)源:參考資料[1]
創(chuàng )勝集團由邁博斯生物與奕安濟世生物于2019年1月合并而來(lái)��,錢(qián)雪明博士為創(chuàng )勝集團共同創(chuàng )始人和首席執行官����。2020年12月��,該公司順利完成由中國國有企業(yè)結構調整基金(國調基金)領(lǐng)投的1.05億美元交叉輪融資��。至此����,創(chuàng )勝集團融資總額已超過(guò)3.4億美元�����,投資人包括禮來(lái)亞洲基金�����、淡馬錫���、高瓴資本���、紅杉資本中國基金��、碧桂園創(chuàng )投�����、中信建投資本等���。
招股書(shū)顯示�����,創(chuàng )勝集團已開(kāi)發(fā)功能獨有的抗體發(fā)現平臺�����,即免疫耐受突破(IMTB)技術(shù)平臺��,并利用該平臺生成TST001(靶向Claudin18.2保守表位)及MSB2311(一種與表位結合而令MSB2311具有pH依賴(lài)性抗原結合特性的PD-L1靶向抗體)����。目前�,該公司在研管線(xiàn)已有9種候選藥物����,包括1種核心產(chǎn)品MSB2311和4種關(guān)鍵候選藥物��。
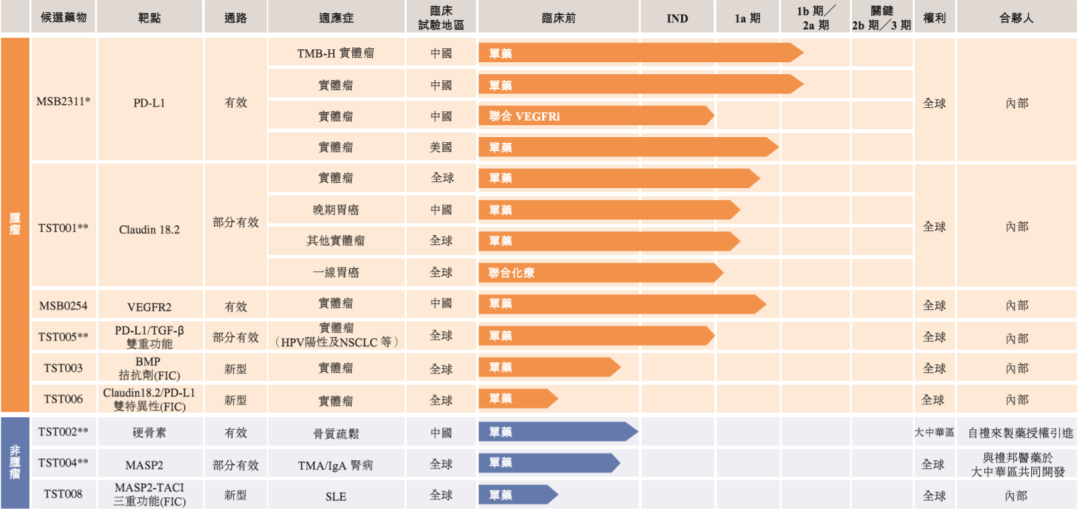
▲創(chuàng )勝集團產(chǎn)品管線(xiàn)(圖片來(lái)源:參考資料[1])
1����、MSB2311:根據招股書(shū)��,這是一款第二代PD-L1抑制劑����,較其他PD(L)-1抗體具有獨特性�����。MSB2311是借助IMTB平臺及內部抗體庫發(fā)現及開(kāi)發(fā)的一款「再循環(huán)」PD-L1抗體�����,具有pH依賴(lài)性PD-L1結合特性�����,可極大延長(cháng)藥物靶標在腫瘤的停留時(shí)間及提高體內腫瘤的殺傷活性���。此前��,該產(chǎn)品已在中國開(kāi)展1期研究����。據介紹���,MSB2311將作為高腫瘤突變負荷(TMB-H)泛型實(shí)體瘤的單藥療法在2期研究中進(jìn)一步評估��。此外�,MSB2311還可能聯(lián)合抗血管生成抑制劑針對部分實(shí)體瘤(包括宮頸癌�����、食管癌��、結直腸癌及肺癌)患者開(kāi)展研究��。
2�����、TST001:一種針對實(shí)體瘤的人源化Claudin18.2單抗候選藥物�。Claudin18.2在正常情況下僅在胃粘膜已分化的上皮細胞中表達��,但在胃食管癌�����、胰腺癌和其他實(shí)體瘤中通常存在過(guò)度表達的情況��。TST001的作用機理在于�,通過(guò)ADCC的機制來(lái)殺死腫瘤細胞���。據悉�,該在研項目具有更高親和力���,更低的唾液酸糖蛋白和與之不同的結合表位�,對于有Claudin18.2表達的腫瘤細胞���,尤其是Claudin18.2低表達的腫瘤細胞���,其ADCC活性可增強100倍以上����。目前���,TST001正在美國及中國進(jìn)行1期試驗����,以評估其安全性及耐受性�,以及于晚期實(shí)體瘤(包括但不限于胃癌及胰腺癌)患者的抗腫瘤活性��。
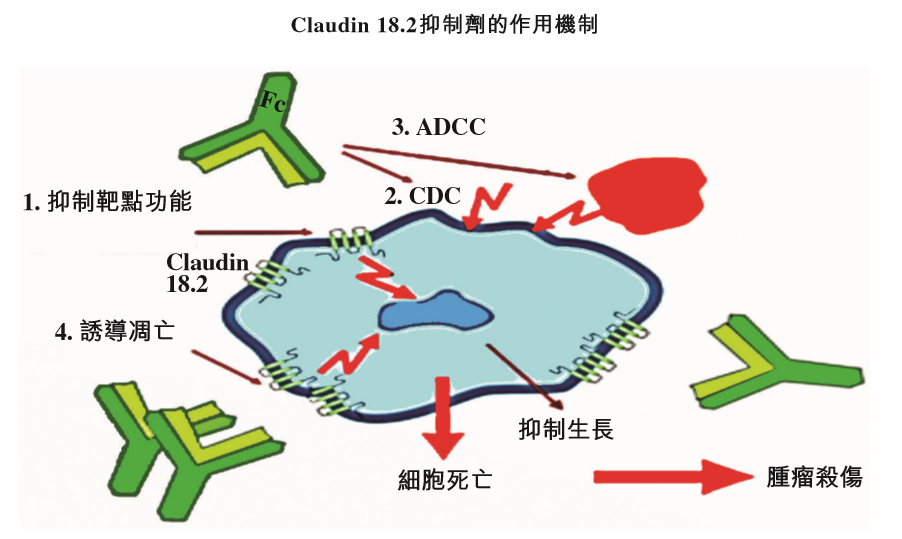
截圖來(lái)源:參考資料[1]
3�����、TST005:一種針對實(shí)體瘤的PD-L1/TGF-β雙重特定抗體候選藥物��,由高親和力PD-L1抗體組成���,在其c端與TGF-β受體II型融合�。作為一種雙功能抗體����,TST005的PD-L1結合活性及增強的TGF-β陷阱穩定性可將TGF-β陷阱有針對性地遞送至表達PD-L1的腫瘤���,從而將全身性抑制TGF-β的脫靶毒性降至最低�����。研究表明��,TST005在逆轉TGF-β誘導的T細胞抑制中顯示出強大的體外活性��,且具有良好的耐受性�,并顯示出線(xiàn)性PK特征����。創(chuàng )勝集團已于2021年3月向美國FDA提交TST005的IND申請��。
4�����、TST002(blosozumab)����,一種針對骨質(zhì)疏松的人源化硬骨素單抗候選藥物����。研究表明��,在接受抗硬骨素抗體治療或自然發(fā)生的基因缺失的人群中�,阻斷硬骨素活性是提高骨密度(BMD)及減少骨折的有效方法�����。Blosozumab具有合成代謝和抗吸收的雙重作用���,可刺激骨骼形成并抑制骨骼吸收�����,從而在提升骨骼密度和骨骼強度方面產(chǎn)生快速作用�。禮來(lái)公司(Eli Lilly and Company)在美國和日本完成對blosozumab的2期研究后����,創(chuàng )勝集團于2019年獲禮來(lái)授權引進(jìn)blosozumab以在大中華區進(jìn)行開(kāi)發(fā)及商業(yè)化���。目前�����,該公司已完成技術(shù)轉讓及開(kāi)發(fā)了制造工藝���,預計將于2021年7月在中國提交IND申請����。
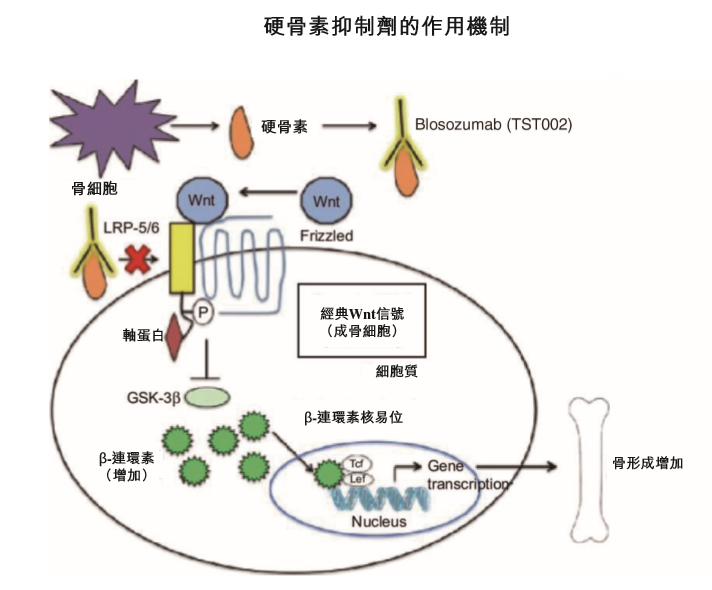
截圖來(lái)源:參考資料[1]
5�、TST004:一種靶向甘露聚糖結合凝集素絲氨酸蛋白酶2(MASP2)的人源化單克隆抗體�,被設計為可防止凝集素途徑補體介導的炎癥��,創(chuàng )勝集團計劃開(kāi)發(fā)TST004用于IgA腎?���。↖gAN)�。此外�����,TST004還在多個(gè)其他適應癥如血栓性微血管?�。═MA)中具有治療潛力�����,且給藥頻率可能會(huì )更低�,靶標覆蓋范圍更完整���。目前��,創(chuàng )勝集團正與禮邦醫藥合作在大中華區開(kāi)發(fā)及商業(yè)化TST004用于治療與TMA���、腎臟疾病及血液疾病有關(guān)的若干適應癥(不包括眼科及傳染病適應癥)�����,并保留世界其他地區的權利����。
此外�����,創(chuàng )勝集團還在開(kāi)發(fā)的候選藥還有:MSB0254�����,一種針對實(shí)體瘤的人源化VEGFR-2單克隆抗體�����;TST003��,一種新型免疫調節蛋白的抗體候選藥物��;TST006�����,一種雙特異性Claudin18.2/PD-L1抗體���;TST008���,一種結合MASP2抗體并與截短的跨膜激活劑及CAML相互作用分子(TACI)蛋白融合的三重功能抗體��。
根據招股書(shū)���,為實(shí)現創(chuàng )勝集團為全球患者提供高質(zhì)量及可支付得起的創(chuàng )新生物藥的愿景��,他們將通過(guò)臨床開(kāi)發(fā)快速推進(jìn)其腫瘤藥物專(zhuān)營(yíng)權��,加快其他IND籌備及臨床前階段候選藥物的開(kāi)發(fā)�����,通過(guò)加大自主發(fā)現及業(yè)務(wù)拓展力度增強其產(chǎn)品管線(xiàn)��,并充分發(fā)揮其候選藥物的全球價(jià)值等�����。
我們期待創(chuàng )勝集團的港交所之行順利�,以更多力量助力新藥研發(fā)�,造福更多病患���。
轉載:醫藥觀(guān)瀾