中國蘇州和美國馬里蘭州羅克維爾市�,2021年11月5日—致力于在腫瘤�����、乙肝及與衰老相關(guān)疾病等治療領(lǐng)域開(kāi)發(fā)創(chuàng )新藥物的領(lǐng)先的生物醫藥企業(yè)——亞盛醫藥(6855.HK)今日宣布��,公司在研原創(chuàng )1類(lèi)新藥奧雷巴替尼(Olverembatinib��,HQP1351�,曾用名耐克替尼��、奧瑞巴替尼)共有三項臨床進(jìn)展入選第63屆美國血液學(xué)會(huì )(American Society of Hematology�����,ASH)年會(huì )����,其中一項獲口頭報告�。北京大學(xué)人民醫院血液科黃曉軍教授和江倩教授是該口頭報告相關(guān)研究的主要研究者�,江倩教授將在會(huì )議期間作此報告��。這是奧雷巴替尼的臨床進(jìn)展連續第四年入選ASH年會(huì )口頭報告��,充分顯示了國際血液學(xué)界對其療效和安全性的認可��。
奧雷巴替尼是亞盛醫藥在研原創(chuàng )1類(lèi)新藥�����,是新型的第三代BCR-ABL酪氨酸激酶抑制劑(Tyrosine Kinase Inhibitor�,TKI)��,用于治療對一代�����、二代TKI耐藥的慢性髓性白血?����。–ML)����,特別是對T315I突變的CML患者具有很好的療效��。目前�����,亞盛醫藥在中國遞交的奧雷巴替尼新藥上市申請(NDA)已在審評過(guò)程中���,用于治療伴有T315I突變的CML慢性期(CML-CP)及加速期(CML-AP)患者���,并已被納入優(yōu)先審評���。此外���,奧雷巴替尼還獲中國國家藥品監督管理局(NMPA)新藥審評中心(CDE)納入突破性治療品種����,擬治療一代和二代TKI耐藥和/或不耐受的CML-CP患者��。
每年一度的ASH年會(huì )是全球血液學(xué)領(lǐng)域規模最大���、涵蓋最全面的國際學(xué)術(shù)盛會(huì )之一��,匯聚該領(lǐng)域最新�����、最前沿的研發(fā)進(jìn)展����。第63屆ASH年會(huì )將于2021年12月11日至14日在美國亞特蘭大以線(xiàn)下結合線(xiàn)上的形式舉行���。今年�,亞盛醫藥共有三個(gè)在研新藥(奧雷巴替尼�、APG-2575��、APG-1252)的六項臨床研究入選ASH年會(huì )展示及報告(APG-2575和APG-1252相關(guān)研究的詳細信息參見(jiàn)同期發(fā)布的另一篇新聞稿)����。
亞盛醫藥首席醫學(xué)官翟一帆博士表示:“奧雷巴替尼將在2021 ASH年會(huì )上展示的臨床研究數據展現了良好的療效和耐受性���,令人振奮�。該藥物的研究進(jìn)展連續四年入選ASH口頭報告���,更充分顯示了國際血液學(xué)界對奧雷巴替尼這一潛在CML治療藥物的認可��。作為中國首個(gè)��、全球第二個(gè)三代BCR-ABL抑制劑�,奧雷巴替尼為耐藥CML患者提供了一種療效確切���、安全性更好的治療方案�。我們迫切地期待奧雷巴替尼早日獲批上市���,從而造福中國乃至全球的耐藥CML患者��?���!?/span>
奧雷巴替尼入選2021 ASH年會(huì )的研究摘要如下:
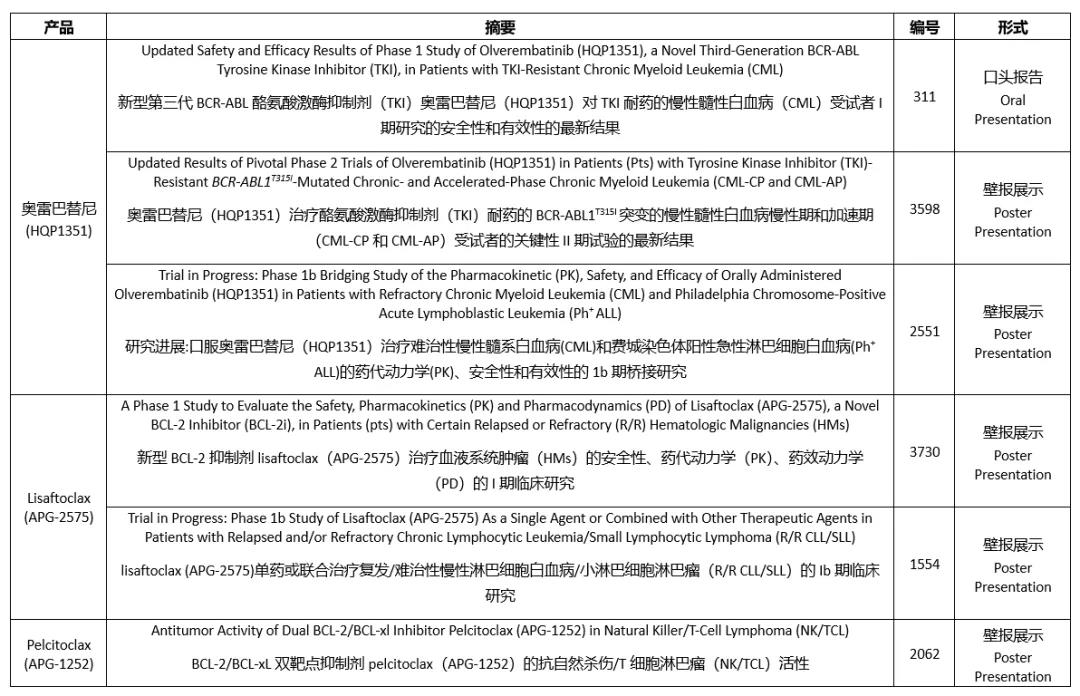
Updated Safety and Efficacy Results of Phase 1 Study of Olverembatinib (HQP1351), a Novel Third-Generation BCR-ABL Tyrosine Kinase Inhibitor (TKI), in Patients with TKI-Resistant Chronic Myeloid Leukemia (CML)
新型第三代BCR-ABL酪氨酸激酶抑制劑(TKI)奧雷巴替尼(HQP1351)對TKI耐藥的慢性髓性白血?���。–ML)受試者I期研究的安全性和有效性的最新結果
■?展示形式:口頭報告
■?摘要編號:311
■?分會(huì )場(chǎng):632. Chronic Myeloid Leukemia: Clinical and Epidemiological: Mechanisms of resistance and expanded therapies(慢性髓性白血?。号R床及流行病學(xué)進(jìn)展:抗藥機制及新興療法)
■?報告時(shí)間:美國東部時(shí)間2021年12月11日�����,星期六�,5:00 PM /北京時(shí)間2021年12月12日����,星期日�����,6:00 AM
■?核心要點(diǎn):
這項在中國進(jìn)行的開(kāi)放性�、多中心的I期臨床試驗評估了奧雷巴替尼對處于慢性期(CML-CP)或加速期(CML-AP)的成人CML受試者的安全性和有效性�����。符合條件的受試者包括對第一代或第二代TKIs耐藥或不耐受的CML-CP或CML-AP患者����。奧雷巴替尼的使用方式為口服�����、隔天給藥�、28天為一個(gè)周期����,共有范圍從1至60 mg的11個(gè)劑量組�。本研究報告了有長(cháng)期隨訪(fǎng)記錄的受試者數據�����。
2016年10月26日至2021年2月2日(數據截止日期)期間����,101例CML-CP(n=86)和CML-AP(n=15)受試者被納入研究并接受奧雷巴替尼的治療�。71例(70.3%)受試者為男性�����,中位(范圍)年齡為40(20-64)歲�。從診斷為CML到第一次服用奧雷巴替尼的中位(范圍)時(shí)間間隔為6.0(0.3-15.2)年��。84例(83.2%)受試者之前接受過(guò)≥2種TKI-治療�����,63例(62.4%)受試者存在T315I突變��。11例(10.9%)受試者在基線(xiàn)時(shí)被檢測出有復合突變�����,其中7例(63.6%)具有BCR-ABL1T315I的基因突變�����。共20例(19.8%)受試者有2個(gè)(n=13)或≥3個(gè)(n=7)突變��。中位隨訪(fǎng)時(shí)間為30.8(1.2-51.8)個(gè)月����。至數據截止日���,在101例受試者中有81例(80.2%)繼續接受治療�����,18例(17.8%)的治療時(shí)間超過(guò)3年��,5例(5%)的治療時(shí)間超過(guò)4年�����。
基線(xiàn)時(shí)未獲得緩解的可評估受試者中�,血液學(xué)完全緩解率(CHR)為97.0%�,細胞遺傳學(xué)完全緩解率(CCyR)為62.1%��,深度分子生物學(xué)緩解率(MMR)為51.0%���。
-? 在CML-CP受試者中�,攜帶T315I突變的可評估受試者的CHR為100%��, 顯著(zhù)細胞遺傳學(xué)緩解率(MCyR)為83.7%的�,MMR為71.2%���;
-? 在CML-AP受試者中���,CHR為80.0%�,MCyR和MMR均為54.5%�����。
在第36個(gè)月時(shí)��,CML-CP和CML-AP受試者的無(wú)進(jìn)展生存(PFS)率分別為96.3%(89.1%-98.8%)和71.4%(40.6%-88.2%)��。
奧雷巴替尼帶來(lái)的緩解是持久的��,且不受基線(xiàn)BCR-ABL1突變狀態(tài)的影響�����。治療時(shí)間超過(guò)4年的受試者的CHR為100%���,CCyR為80%���,MMR為60%��。平均PFS率在第36個(gè)月時(shí)為100%����,第48個(gè)月時(shí)為100%����,而在第60個(gè)月時(shí)尚未達到(NR-NR)�����。
大部分與治療相關(guān)的不良事件為1級或2級����。
-??最常見(jiàn)的非血液學(xué)不良事件(大部分為1或2級)是皮膚色素沉著(zhù)(86.1%)��;3級或以上的非血液學(xué)不良事件包括高甘油三酯血癥(10.9%)��、發(fā)熱(6.9%)和蛋白尿(5.0%)���。
-??最常見(jiàn)的與治療相關(guān)的血液學(xué)不良事件為78例(77.2%)患者出現的血小板計數減少���,其中包括52例(51.5%)≥3級不良事件��;21例(20.8%)受試者的白細胞計數減少為3級或以上�����,但不嚴重���;16例(15.8%)受試者的貧血為3級或以上��。
結論:奧雷巴替尼對TKI耐藥的CML-CP或CML-AP和長(cháng)期治療的受試者均有良好的療效和耐受性��。
Updated Results of Pivotal Phase 2 Trials of Olverembatinib (HQP1351) in Patients (Pts) with Tyrosine Kinase Inhibitor (TKI)-Resistant BCR-ABL1T315I-Mutated Chronic- and Accelerated-Phase Chronic Myeloid Leukemia (CML-CP and CML-AP)
奧雷巴替尼(HQP1351)治療酪氨酸激酶抑制劑(TKI)耐藥的BCR-ABL1T315I突變的慢性髓性白血病慢性期和加速期(CML-CP和CML-AP)受試者的關(guān)鍵性II期試驗的最新結果
■?展示形式:壁報展示
■?摘要編號:3598
■?分會(huì )場(chǎng):632. Chronic Myeloid Leukemia: Clinical and Epidemiological: Poster III (慢性髓性白血?����。号R床及流行病學(xué)進(jìn)展:壁報展示III)
■?報告時(shí)間:美國東部時(shí)間2021年12月13日��,星期一���,6:00 PM – 8:00 PM / 北京時(shí)間2021年12月14日�,星期二��,7:00 AM – 9:00 AM
■?核心要點(diǎn):
HQP1351-CC201和HQP1351-CC202是在中國進(jìn)行的開(kāi)放性���、單臂�、多中心的關(guān)鍵性注冊II期臨床研究����,分別評估了奧雷巴替尼對TKI耐藥(BCR-ABL1T315I突變)的CML-CP和CML-AP成人受試者的安全性和有效性�。奧雷巴替尼的使用方式為40 mg口服��、隔天給藥���、28天為一個(gè)周期�����。
截至2020年8月25日�,HQP1351-CC201共入組41例CML-CP患者���,其中32例(78%)完成了≥12個(gè)周期��,中位隨訪(fǎng)時(shí)間為13(3.1-16.3)個(gè)月����?��;€(xiàn)時(shí)沒(méi)有反應的受試者在≥12個(gè)治療周期后���,CHR達到100%���。MCyR為75.6%(31/41)���,CCyR率為68.3%(28/41)�,MMR為56.1%(23/41)��。受試者在第12個(gè)月的PFS率為89.3%, 總生存(OS)率為100%���。
截至2020年7月27日�����,HQP1351-CC202共入組23例CML-AP患者�,其中14例(61%)完成了≥12個(gè)周期��,中位隨訪(fǎng)時(shí)間為13.5(1.4-15.2)個(gè)月���?�;€(xiàn)時(shí)沒(méi)有反應的受試者在≥12個(gè)治療周期后��,血液學(xué)深度緩解率(MaHR)達到73.9%(17/23)���,MCyR為52.2%(12/23)����,CCyR為47.8%%(11/23)��,MMR為39.1%(9/23)���。受試者在第12個(gè)月的PFS率為74.1%, OS率為91.3%��。
在HQP1351-CC201中最常見(jiàn)的3級/4級治療相關(guān)不良反應(TRAE)是血小板減少(48.8%)��,沒(méi)有治療相關(guān)性死亡發(fā)生�����。
在HQP1351-CC202中最常見(jiàn)的3級/4級TRAE是血小板減少(56.5%)�����。
結論:奧雷巴替尼單藥治療在TKI耐藥的CML-CP和CML-AP以及BCR-ABL1T315I突變的CML受試者中均有良好的療效和耐受性�。
Trial in Progress: Phase 1b Bridging Study of the Pharmacokinetic (PK), Safety, and Efficacy of Orally Administered Olverembatinib (HQP1351) in Patients with Refractory Chronic Myeloid Leukemia (CML) and Philadelphia Chromosome-Positive Acute Lymphoblastic Leukemia (Ph+ ALL)
研究進(jìn)展:口服奧雷巴替尼(HQP1351)治療難治性慢性髓系白血病(CML)和費城染色體陽(yáng)性急性淋巴細胞白血病(Ph+ ALL)的藥代動(dòng)力學(xué)(PK)��、安全性和有效性的1b期橋接研究
■?展示形式:壁報展示
■?摘要編號:2551
■?分會(huì )場(chǎng):632. Chronic Myeloid Leukemia: Clinical and Epidemiological: Poster II(慢性髓性白血?�。号R床及流行病學(xué)進(jìn)展:壁報展示II)
■?時(shí)間:美國東部時(shí)間2021年12月12日�,星期日�����,6:00 PM – 8:00 PM / 北京時(shí)間2021年12月13日�,星期一��,7:00 AM – 9:00 AM
■?核心要點(diǎn):
這項在美國開(kāi)展的開(kāi)放性的橋接試驗旨在評估奧雷巴替尼對伴有或不伴有T315I突變的慢性期��、加速期或急變期CML (CML-CP�����、CML-AP或CML-BP)和Ph+ ALL的成人受試者的藥代動(dòng)力學(xué)(PK)����、安全性和有效性���。奧雷巴替尼的使用方式為口服��、隔天給藥�。
目前��,這項研究正在招募受試者��,篩選合格的受試者將被隨機分配到3個(gè)劑量組:30�、40或50mg���。研究終點(diǎn)包括PK�,抗腫瘤活性和安全性�����。
關(guān)于亞盛醫藥
亞盛醫藥是一家立足中國�、面向全球的處于臨床開(kāi)發(fā)階段的原創(chuàng )新藥研發(fā)企業(yè)����,致力于在腫瘤����、乙肝及與衰老相關(guān)的疾病等治療領(lǐng)域開(kāi)發(fā)創(chuàng )新藥物����。2019年10月28日����,亞盛醫藥在香港聯(lián)交所主板掛牌上市���,股票代碼:6855.HK�����。
亞盛醫藥擁有自主構建的蛋白-蛋白相互作用靶向藥物設計平臺��,處于細胞凋亡通路新藥研發(fā)的全球最前沿�����。公司已建立擁有8個(gè)已進(jìn)入臨床開(kāi)發(fā)階段的1類(lèi)小分子新藥產(chǎn)品管線(xiàn)��,包括抑制Bcl-2����、IAP 或 MDM2-p53 等細胞凋亡路徑關(guān)鍵蛋白的抑制劑���;新一代針對癌癥治療中出現的激酶突變體的抑制劑等�,為全球唯一在細胞凋亡路徑關(guān)鍵蛋白領(lǐng)域均有臨床開(kāi)發(fā)品種的創(chuàng )新公司��。目前公司正在中國�、美國����、澳大利亞及歐洲開(kāi)展40多項I/II期臨床試驗���。公司先后承擔多項國家科技重大專(zhuān)項��,其中“重大新藥創(chuàng )制”專(zhuān)項5項�,包括1項“企業(yè)創(chuàng )新藥物孵化基地”及4項“創(chuàng )新藥物研發(fā)”�,另外承擔“重大傳染病防治”專(zhuān)項1項�。用于治療耐藥性慢性髓性白血病的核心品種奧雷巴替尼已在中國遞交新藥上市申請����,并獲納入優(yōu)先審評和突破性治療品種�����。該品種還獲得了美國FDA審評快速通道及孤兒藥認證資格��。截至目前���,公司共有4個(gè)在研新藥獲得12項FDA孤兒藥認證資格���。
憑借強大的研發(fā)能力�,亞盛醫藥已在全球范圍內進(jìn)行知識產(chǎn)權布局�����,并與UNITY��、MD Anderson�����、梅奧醫學(xué)中心和Dana-Farber癌癥研究所���、默沙東���、阿斯利康等領(lǐng)先的生物技術(shù)及醫藥公司���、學(xué)術(shù)機構達成全球合作關(guān)系�。公司已建立一支具有豐富的原創(chuàng )新藥研發(fā)與臨床開(kāi)發(fā)經(jīng)驗的國際化人才團隊��,同時(shí)��,公司正在高標準打造后期的商業(yè)化生產(chǎn)及市場(chǎng)營(yíng)銷(xiāo)團隊�。亞盛醫藥將不斷提高研發(fā)能力�,加速推進(jìn)公司產(chǎn)品管線(xiàn)的臨床開(kāi)發(fā)進(jìn)度����,真正踐行“解決中國乃至全球患者尚未滿(mǎn)足的臨床需求”的使命�,以造福更多患者����。
前瞻性聲明
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關(guān)�����。除法律規定外����,于作出前瞻性陳述當日之后�,無(wú)論是否出現新資料�����、未來(lái)事件或其他情況��,我們并無(wú)責任更新或公開(kāi)修改任何前瞻性陳述及預料之外的事件����。請細閱本文��,并理解我們的實(shí)際未來(lái)業(yè)績(jì)或表現可能與預期有重大差異���。本文內所有陳述乃本文章刊發(fā)日期作出����,可能因未來(lái)發(fā)展而出現變動(dòng)����。