
2015年以來(lái)的藥審改革開(kāi)啟了國內創(chuàng )新藥行業(yè)浪潮���,近年國內新藥研發(fā)體系逐步升級���,熱門(mén)靶點(diǎn)的布局進(jìn)入收獲期��,一批biotech成長(cháng)為具備商業(yè)化能力的biopharma����,以L(fǎng)icense-out為代表的出海交易頻現����,同時(shí)也伴隨著(zhù)估值泡沫與同質(zhì)化問(wèn)題的愈發(fā)凸顯��,中國創(chuàng )新藥路在海外����,卻并非坦途�����。
為何要出海:
研發(fā)投入與募資/支付端的艱難博弈
研發(fā)高投入:僅以百濟神州為例��,2月28日�,百濟神州發(fā)布2021年美股年報���,2021年度收入約12億美元�,同比增長(cháng)約280.8%�����;實(shí)現歸屬于公司的凈虧損約14.1億美元��,較2020年度虧損有所收窄���;公司研發(fā)費用約14.6億美元�����,同比增加約1.6億美元�。另一家龍頭恒瑞醫藥在2021年11月20日公告��,將此前的研發(fā)費用在發(fā)生時(shí)計入當期損益變更為根據研發(fā)項目所處的不同階段區別對待�。過(guò)往��,恒瑞將研發(fā)項目的所有支出于發(fā)生時(shí)全部費用化處理��。
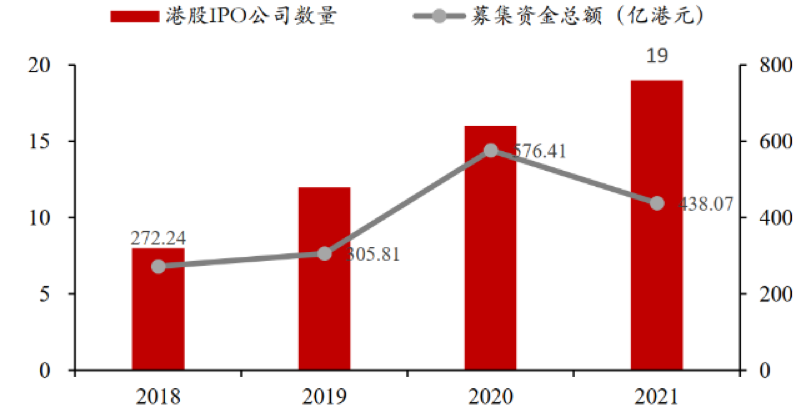
資本低反饋:資本市場(chǎng)上�����,2021年下半年創(chuàng )新藥指數跌幅明顯�。截至2021年年底整個(gè)板塊的估值已經(jīng)從2020年最高點(diǎn)98.8回落到39.89�,而最近4年中處于平均估值水平51.64�����。IPO看����,2021年以來(lái)�,在港上市的中國制藥���、生物科技與生命科學(xué)企業(yè)為19家�,略多于2020年的16家�。但IPO募資總額438.07億港元比上一年的576.41億港元下降了約24%���。
圖1:2017-2021年主要企業(yè)研發(fā)投入
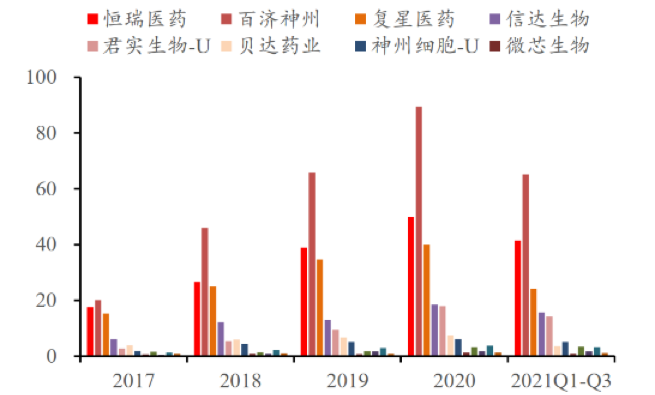
圖2:2018-2021年港股生物藥IPO數量和募資總額
支付漸收緊:2020年����,我國基本醫?�;鹗杖?4846億元����,增速為1.74%�����;同年我國基本醫?;鹬С鰹?1032億元���,增速為0.85%��,收入增速大于支出增速�����,且均呈現放緩趨勢�。原因主要是:受疫情影響���,全國多地實(shí)施階段性減半征收職工醫保單位繳費���,使得職工醫保收入較上年下降�。
圖3:2010-2020年我國醫?;鹬С龊驮鏊偾闆r
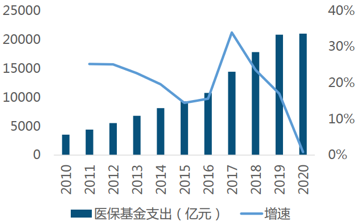
圖4:2010-2020年我國醫?����;鹩嗪驮鏊偾闆r
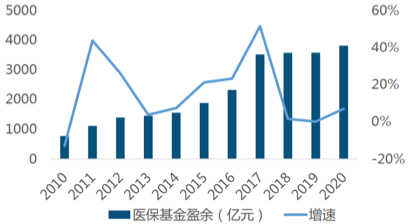
2018-2019年醫?;鹬С鲈鏊龠B續兩年高于收入增速�����,但在2020年實(shí)現反轉�。醫?���;鹩喾矫?,2020年我國醫?���;鹩酁?814億元�,增速為6.92%��,與前兩年相比�,增速有較大幅度的提升����。醫?���;鹬С鲈鏊傧禄黠@的原因主要是:國家醫保局開(kāi)展了價(jià)格談判���、集采等控制藥價(jià)的措施�。2021年《醫保藥品管理改革進(jìn)展與成效藍皮書(shū)》指出����,集采以來(lái)���,患者用藥負擔明顯減輕�����,醫?��;饓毫Υ蟠缶徑?���。截至2021年9月��,累計節約醫?��;鹳M用約2500億元�����。
圖5:國內實(shí)際銷(xiāo)售額�����,增長(cháng)遇到極大瓶頸

研發(fā)的投入需求是迫切的���,同時(shí)資本是現實(shí)的��,如果難有高額的回報���,無(wú)論是融資的困境還是二級市場(chǎng)的估值下降����,都會(huì )在短時(shí)間內直接的體現出來(lái)���;同時(shí)支付端尤其是最大的支付方醫保的控制力度也是近乎剛性的�����。所以創(chuàng )新藥公司繼續只講針對中國市場(chǎng)的故事����,尤其是在同行的產(chǎn)品線(xiàn)過(guò)于相似的情況下��,已經(jīng)逐漸成為了一個(gè)偽命題�����。
為何能出海:
源自產(chǎn)業(yè)鏈十年的積累
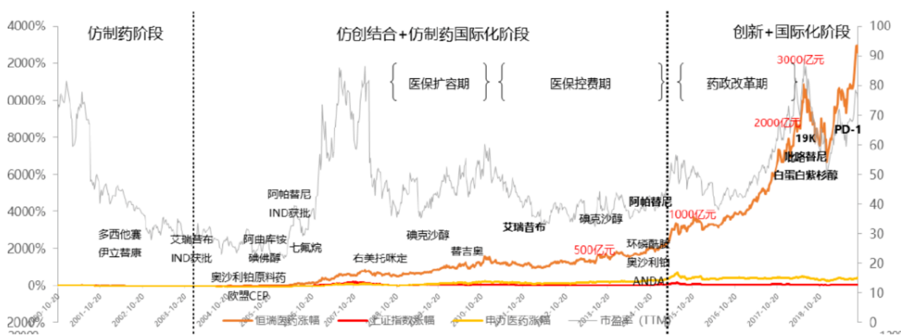
做過(guò)去幾十年����,中國醫藥歷經(jīng)了從“仿制→仿創(chuàng )結合→創(chuàng )新��,良莠不齊→唯優(yōu)取勝����,國內→出?���!钡恼麄€(gè)發(fā)展歷程���,恒瑞的發(fā)展史就是一個(gè)典型的代表����。
來(lái)源:天風(fēng)證券
仿創(chuàng )結合+仿制藥階段(2003-2015年):薄弱的中國醫藥產(chǎn)業(yè)度過(guò)了從零開(kāi)始��、仿制常用藥的階段��,逐步進(jìn)入仿創(chuàng )結合和高端仿制藥階段����。期間經(jīng)歷了醫??焖贁U容期�,國內企業(yè)但凡有好的品種都經(jīng)歷了快速增長(cháng)�,2010年起告別了野蠻生產(chǎn)期�����,我國開(kāi)始逐步步入醫?�?刭M階段��。
創(chuàng )新+國際化階段(2015-至今):2015年7.22事件開(kāi)始的臨床自查打響了藥政改革的第一槍?zhuān)S著(zhù)CDE快速審評審批等一系列鼓勵創(chuàng )新的政策不斷推出����、中國自主創(chuàng )新藥如澤布替尼在海外上市及License out deal數量����、金額屢創(chuàng )新高��,新老藥企紛紛進(jìn)行創(chuàng )新布局�����。
薄弱的研發(fā)基礎+快速回流的人才+寬松的專(zhuān)利制度+熱情的資本+注冊制IND審批��,掀起了創(chuàng )業(yè)和發(fā)展的狂潮����。2010年左右大量海歸科學(xué)家在資本吸引下回國創(chuàng )業(yè)���,這些科學(xué)家都曾在國際大藥企有多年實(shí)踐經(jīng)驗���,極具國際視野���。在當時(shí)中國與海外因審批時(shí)間差異而缺藥(尤其是生物藥)情況下����,通過(guò)同時(shí)布局Me-too + Me-better + FIC/BIC的“穩定現金流+高溢價(jià)”管線(xiàn)迅速抓到紅利��,徹底點(diǎn)燃了新藥研發(fā)及創(chuàng )業(yè)熱情�����,大熱的生物類(lèi)似藥����、PD-1單抗����、BTK抑制劑等都源于此�����。依托這在仿制藥階段的積累�����,中國創(chuàng )新藥來(lái)到了走出國門(mén)的關(guān)口�。我們主要擁有以下4方面優(yōu)勢:
??部分產(chǎn)品已展現出差異化數據及全球競爭力
百濟神州的BTKi澤布替尼有望在CLL/SLL領(lǐng)域直接參與全球性的數據與商業(yè)競爭外�����,榮昌生物的RC48相比其他HER2-ADC以曲妥珠單抗(Trastuzumab)為抗體端��,采取自主研發(fā)具備更強內吞效應的HER2單抗��,有望在尿路上皮癌及HER2中低表達乳腺癌中這樣未被滿(mǎn)足的需求中取得優(yōu)勢��;天境生物和康方生物的CD47單抗經(jīng)多輪抗體篩選���,在紅細胞/血小板的毒副作用遠小于吉列德/FortySeven的同類(lèi)產(chǎn)品����;諾誠健華的BTKi奧布替尼具良好的穿透血腦屏障潛力����,有望在多發(fā)性硬化上打造差異化的適應癥�;康方生物和康寧杰瑞以PD(L)-1為骨架的雙抗進(jìn)度超前�,有望成為全球First in class產(chǎn)品�。
??在資本及CXO助力下
? 部分國內藥企已具備在海外建立團隊的能力
頭部創(chuàng )新藥公司如恒瑞�����、百濟�����、信達等均已在美國建立研發(fā)實(shí)驗室��、臨床���、全球準入���、BD甚至商業(yè)化團隊���,并由在MNC多年經(jīng)驗的外國頂級科學(xué)家領(lǐng)導����;榮昌生物和天境生物在美國擁有抗體優(yōu)化團隊����;康方生物在澳洲的臨床團隊保證提前澳洲納入海外數據�����;信達生物在美國有100人以上的全球法規/準入團隊�;諾誠健華在波士頓的BD團隊保證獲得第一線(xiàn)消息�;百濟神州的美國血液瘤商業(yè)化團隊近200人��,媲美MNC的美國團隊����。
??中國B(niǎo)iotech相較其他國家可在成本��、
? 速度�����、勤奮方面更具優(yōu)勢���,實(shí)現國內外套利
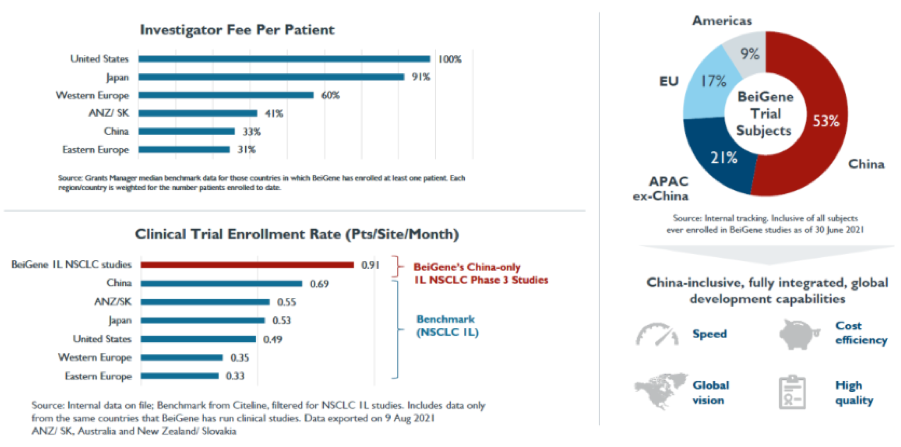
中國臨床受試者單人成本僅占美國1/3�����,在全球多中心臨床可以通過(guò)招募更多亞裔受試者減少在藥物研發(fā)中最花錢(qián)部分的支出�;當然����,具體各中心的患者占比要更加從科學(xué)的角度和FDA的最新監管要求通盤(pán)考慮����,完全的中國患者數據會(huì )面臨失敗的風(fēng)險�;中國醫療資源在地緣上不平均造成的北上廣大三甲PI患者資源豐富����,反而可以加快入組��;中國人處于時(shí)代賦予的特殊時(shí)期�,工作效率遠高于海外市場(chǎng)���。
圖7:百濟神州2021年R&D Day–臨床速度和費用中國市場(chǎng)均有優(yōu)勢
??支付價(jià)格降低下MNC需要中國利益互換伙伴
4+7集采��、醫保談判降價(jià)等因素導致中國市場(chǎng)利潤率顯著(zhù)降低����,降價(jià)也可能破壞全球價(jià)格體系����,MNC參與度降低����;嚴格的合規要求也使公司銷(xiāo)售靈活度不如本土公司����。就在中國是否有必要設置大規模銷(xiāo)售團隊��、與國內Biotech如何通過(guò)合作使利益最大化的問(wèn)題上�����,我們可以看到���,如信達生物與禮來(lái)的PD-1國內銷(xiāo)售曾分區域合作��,百濟神州獲得安進(jìn)及諾華部分產(chǎn)品中國權益�����。雖然市場(chǎng)對于創(chuàng )新藥在中國銷(xiāo)售呈現悲觀(guān)��,但在2021年末的諾華R&D上��,諾華在2024年的目標是中國銷(xiāo)售額翻倍���,仍展現對中國市場(chǎng)的樂(lè )觀(guān)態(tài)度��。作為國際合作的有利補充�,未來(lái)MNC與中國B(niǎo)iotech將進(jìn)行更多更深入的綁定及中國地區商業(yè)化合作���,形成雙向授權的互動(dòng)��。
2021 年�,重復建設帶來(lái)的“內卷式”?競爭壓力與落地前不確定性的焦慮是影響生物科技繁榮的主要因素����,市場(chǎng)普遍判斷快速推進(jìn)具備全球競爭力的創(chuàng )新并邁向國際市場(chǎng)是國內創(chuàng )新藥行業(yè)的發(fā)展主題���,臨床數據與申報落地成為鑒真的核心標準����。在這里�����,我們可以根據不同的模式/階段��,把創(chuàng )新藥出海分為4個(gè)階段:
表1:創(chuàng )新藥出海4階段

目前���,我國企業(yè)已可以實(shí)現臨床國際化����,通過(guò)招募海外背景的CMO在美國設立運營(yíng)團隊開(kāi)展新藥臨床申報工作����,依托國內成熟的CRO(提供動(dòng)物藥理/毒理學(xué)研究��、CMC 生產(chǎn)信息)產(chǎn)業(yè)鏈條已經(jīng)能夠獨立完成IND的申請����,借助海外臨床CRO(提供臨床試驗方案和研究員信息)的資源能夠順利推進(jìn)臨床�。
獨立出海背后需要海外基因�、全球運營(yíng)能力�、源源不斷的資本陪跑���、對各國不同準入政策的know-how�、建立當地員工團隊���。當管線(xiàn)足夠豐厚�����,獨立出海而不單純依賴(lài)CRO時(shí)����,每個(gè)新管線(xiàn)的邊際成本將進(jìn)一步遞減��,臨床過(guò)程與海外PI的互動(dòng)也將幫助更好發(fā)論文��、納入指南及被海外醫保覆蓋���。雖然目前僅有頭部公司嘗試�,但市場(chǎng)仍相信這將最大程度實(shí)現套利��,如恒瑞醫藥在美國擁有超過(guò)100人的臨床團隊����,和黃藥業(yè)的賽沃替尼和呋喹替尼預計今明年美國上市��,計劃初期招募50-100人的美國銷(xiāo)售團隊����,繼百濟神州后即將成為第二個(gè)吃螃蟹的人��。
當下而言����,臨床國際化的程度是最高的��,而臨床后的銷(xiāo)售因大多數企業(yè)階段未到或難以建設團隊�,目前是最不成熟的����。即便如此�,以澤布替尼為例�,由百濟神州自主銷(xiāo)售���,據公司公告�����, 1-3Q21美國市場(chǎng)銷(xiāo)售額約0.6億美元����,接近同期國內市場(chǎng)銷(xiāo)售額(約0.7億美元)�,歐美市場(chǎng)的支付能力依舊顯著(zhù)領(lǐng)先國內市場(chǎng)�����。
部分企業(yè)開(kāi)始在國外設立研發(fā)部門(mén)或者通過(guò)收購的方式在海外獨立研發(fā)團隊(前文已介紹)��。
增長(cháng):國內License-out從2016年僅有一個(gè)�,已經(jīng)增長(cháng)至2020年的42個(gè)���,2021年Q3就26個(gè)����,數量增長(cháng)顯著(zhù)�,這表明我國創(chuàng )新出海能力正在持續提升��。國際化項目從熱門(mén)PD-1單抗出海到多前沿靶點(diǎn)ADC��、雙抗類(lèi)型交易�,適應癥從抗腫瘤延伸到自身免疫����、心血管乃至新冠等治療領(lǐng)域�����。百濟神州澤布替尼成功登陸美國市場(chǎng)����,成為史上首位成功出海公司�����;索凡替尼���、特瑞普利單抗�、普納布林����、信迪利單抗等均已提交并處于遞交與受理狀態(tài)�����,眾多產(chǎn)品蓄勢待發(fā)�����。License-out模式帶動(dòng)下��,FDA在多中心中承認中國臨床數據���,有利于國內產(chǎn)品推進(jìn)國際化����。
圖8:中國企業(yè)TOP10的License-out管線(xiàn)

來(lái)源:平安證券
腫瘤和新冠產(chǎn)品為主:2020年-2021年9月�����,授權海外品種中�����,從適應癥來(lái)看���,最多的為抗腫瘤藥���。自疫情爆發(fā)以來(lái)�����,新冠疫苗和治療藥物也成了海外授權重要品種之一�。排在第一的主要出海品種是腫瘤藥����,占了總量的53%���,約有38例���;第二是新冠病毒相關(guān)藥品和疫苗�����,受近年來(lái)新冠疫情影響�,海外授權案例激增��,從無(wú)到有���,占了總授權量的13%��;排在第三位的是中樞神經(jīng)系統用藥(CNS)和免疫系統用藥�,各占10%�,前者和近些年來(lái)老齡化加深引起阿爾茲海默癥增加有關(guān)���。
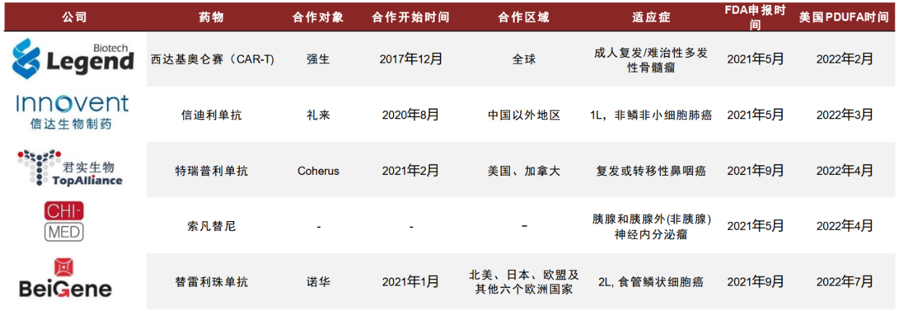
待審批和不認可:2020-2021年���,信達生物���、君實(shí)生物和百濟神州相繼與海外藥企就 PD-1達成合作協(xié)議����,并在 2021年先后啟動(dòng)了海外上市申報��。根據FDA及公司公告��,其將于2022年3月�、4月及7月收到FDA審評結果�。此外��,傳奇生物BCMA CAR-T�����、和黃醫藥索凡替尼亦分別將于2022年2月�、4月收到FDA審評結果�����。以PD-1等產(chǎn)品為代表的海外申報與商業(yè)化落地情況將成為最大催化劑和試金石��,以此為參考���,判斷FDA等海外監管機構對國內臨床數據的認可程度����。但是信達和傳奇的不同審評結果反映�,海外市場(chǎng)的監管機構對中國創(chuàng )新與臨床數據的認可程度并不足夠����。
表2:2022年待落地的中國藥企海外申報主要PDUFA時(shí)間
來(lái)源:中金證券
中國創(chuàng )新藥出海在當下看似必然����,但過(guò)程并非一帆風(fēng)順��,過(guò)去幾個(gè)月整個(gè)行業(yè)籠罩在試驗失敗�、FDA叫停���、對海外市場(chǎng)玩法不熟悉的陰影中���。2021年4月康弘藥業(yè)主動(dòng)叫?��?蛋匚髌杖騃II期試驗���;2021年12月FDA駁回萬(wàn)春藥業(yè)普那布林預防化療藥物造成的中性粒細胞減少癥(CIN)的上市申請要求補做試驗��,股價(jià)跳水到高點(diǎn)的1/15����;同月開(kāi)拓藥業(yè)公布普克魯胺輕中癥非住院新冠患者III期試驗中期結果未達到統計學(xué)顯著(zhù)性��;2022年2月10日信達/禮來(lái)就PD-1向FDA申請一線(xiàn)非鱗狀非小細胞肺癌的ODAC會(huì )議上�,14:1投票通過(guò)需補做試驗���。
Sintilimab信迪利已在4000多名涉及多種腫瘤類(lèi)型的臨床試驗患者中進(jìn)行了評估�,包括招募了700多名患者的一線(xiàn)非小細胞癌研究�����。在中國獲得了四個(gè)適應癥的批準�����,以及超過(guò)170000名患者的上市后安全數據����。信達在ORIENT-11的臨床成功后����,認為有看到FDA清晰的使用外國數據申報的路徑�����,決定向FDA 提交申請���。信達于2020年與FDA會(huì )面了3 次后���,在2021年3月提交了的BLA���。
信達認為:一是信迪利有美國PK數據的支持��;二是認為中國和美國對非小細胞肺癌的診斷和治療是相似的��;三是也認為Sintilimab加化療具有與其他批準的PD1抑制劑一致的可接受的安全性特征�,將提供證據證明ORIENT-11的數據基于這三個(gè)原則適用于美國人群��。
禮來(lái)做為合作方�����,認為信迪利符合使用外國數據批準的規則:
●?研究由具有公認能力的臨床研究人員進(jìn)行�����。
●?FDA能夠通過(guò)現場(chǎng)檢查和其他適當的方式驗證數據��。
●?中國數據可以應用與美國����,包括:中國和美國相似的臨床實(shí)踐�����、中美人群的藥物PD類(lèi)似����,有足夠的證據證明Sintilimab在美國人群中的療效和安全性將與ORIENT-11的中國人群研究相似���。此外���,該藥物類(lèi)別有足夠的臨床經(jīng)驗�����,可以保證該類(lèi)別在具有療效安全性的患者中表現相似�����。?藥代動(dòng)力學(xué)特征是基于514名患者的數據���。對于那些在美國和中國都批準用于相同適應癥的PDL1藥物�����。無(wú)論種族或民族�,劑量和給藥間隔都是相同的���。對于所有被批準用于非小細胞肺癌的PD1/L1���,都沒(méi)有要求對不同種族或民族進(jìn)行調整����。?
針對臨床終點(diǎn)��,禮來(lái)認為如果需要使用FDA指導研究的標準統計假設(OS+頭對頭)���,這樣的試驗將面臨重大的可行性挑戰�,它需要招募2000多名患者��,7年時(shí)間才能完成�。在10月份禮來(lái)與FDA會(huì )面討論了一個(gè)提議���,包括在西方和中國患者之間直接比較Sintilimab 加化療��。同時(shí)禮來(lái)強調���,通過(guò)中國數據申請的方式可以更快的給市場(chǎng)提供更廉價(jià)的藥物���。
但是像很多事情一樣��,思想統一和結論商定是會(huì )前的事����,開(kāi)會(huì )只是擇機發(fā)聲�����。在2月10日的會(huì )議開(kāi)始之前����,FDA在2個(gè)月的時(shí)間多次預熱�����。
●?會(huì )前一個(gè)多月�,2021年12月15日�����,在《新英格蘭醫學(xué)雜志》上����,FDA腫瘤中心主任Richard Pazdur醫師和同事發(fā)表了題為“西部瘋狂式的免疫抑制劑研發(fā)�����,The Wild West of Checkpoint Inhibitor Development”��。文章指出很多中國藥企開(kāi)發(fā)免疫抑制劑類(lèi)藥品���,浪費大量資源于無(wú)創(chuàng )新意義的藥品研發(fā)上��,并自稱(chēng)這些藥為“me better”而不是“me too”����。這些用低于美國臨床對照標準的方式在中國開(kāi)發(fā)的藥��,到美國來(lái)上市是不值得FDA給予照顧的�����。
●?會(huì )前一周����,2022年2月4日����,在《柳葉刀》雜志上�����,Pazdur主任又與同事發(fā)表了題為“從中國輸入臨床試驗:禍水上的橋接����,Importing oncology trials from China: a bridge over troubled water”�����。文章說(shuō)至少有25個(gè)來(lái)自中國的免疫抑制劑類(lèi)新藥申請�,幾乎都是只基于在中國做的臨床試驗數據����,并再次提出FDA是否給予照顧要基于藥品的創(chuàng )新性����。這里所說(shuō)的“照顧”����,是指regulatory flexibility����。通常FDA是不允許用單一國家�,且是與美國的種族譜很不同的國家的臨床試驗數據來(lái)支持在美國上市申請的��。但若是這個(gè)藥有特殊性��,例如全新類(lèi)的藥品����,在美國和其它地區難以入組患者����,臨床急需等等��,就可能給予“照顧”����。
●?會(huì )議當周��,2022年2月7日�,Pazdur主任接受Stat媒體的采訪(fǎng)���,指責中國藥企在鉆FDA監管政策的漏洞���,即原則上允許用美國國外單一國家的臨床試驗數據來(lái)支持上市申請�。并強調FDA批藥只關(guān)注其自身的療效���,不考慮市場(chǎng)競爭因素�����,針對的是“禮來(lái)”號稱(chēng)用廉價(jià)中國藥來(lái)促進(jìn)競爭����、降低藥價(jià)的說(shuō)法���。
FDA 將根據藥物的性質(zhì)和所考慮的數據以靈活的方式應用該政策���。如果數據滿(mǎn)足美國患者未滿(mǎn)足的醫療需求����,則可能需要采用靈活的方法來(lái)接受外國數據�。接受外國數據對于美國的罕見(jiàn)病也很重要�,例如在美國進(jìn)行試驗非常困難�����,但在疾病更常見(jiàn)的國家可行�。在沒(méi)有現有療法的情況下申請同類(lèi)別的新藥也可能具有靈活性�。在特定情況下����,可能需要采用靈活的方法來(lái)評估外國數據的要求��,但這些都不適用于ORIENT-11�����。
●?臨床開(kāi)發(fā)已從ICHE5(1998)過(guò)渡至ICHE17(2017)的全球多中心臨床
多區域臨床試驗允許評估區域一致性���,以直接比較跨地理區域和患者亞群的安全性和有效性結果�����。單一國家試驗通常需要重復或順序橋接研究���,FDA認為這種模式延遲了藥物批準的時(shí)間���,還不如三期直接上全球多中心臨床����。雖然FDA承認藥物成本是一個(gè)對患者有重大影響的重要社會(huì )問(wèn)題����,但FDA不能在監管決策中考慮藥物定價(jià)�,這不應該成為委員會(huì )今天考慮或討論的一部分��。
圖9:向FDA遞交上市申請的腫瘤藥患者來(lái)源:中國參與國際多中心數量顯著(zhù)上升
●?試驗對美國人群和美國醫療實(shí)踐的普遍適用性
ORIENT-11研究人群并未反映美國肺癌患者的種族和民族多樣性�����,接受此類(lèi)研究和類(lèi)似研究與行業(yè)范圍內對臨床試驗公平代表性的承諾相沖突��。
●?試驗應開(kāi)始到結束全階段與FDA積極溝通
FDA認為申請人在任何時(shí)候都沒(méi)有就研究設計或試驗進(jìn)行咨詢(xún)FDA�����。如果咨詢(xún)了FDA�,可能會(huì )建議將Sintilimab與FDA批準的具有總生存期終點(diǎn)的抗體進(jìn)行正式的頭對頭比較���。
基于免疫治療的肺癌方案研究中允許交叉并最終證明了OS益處��,削弱了申請人的立場(chǎng)(PFS終點(diǎn))��,公司應設計頭對頭非劣的臨床方案�。
圖10:默沙東�����、百時(shí)美施貴寶����、羅氏�、再生元都是OS終點(diǎn)

最后�,2016年���,中國國家食品藥品監督管理總局發(fā)布報告稱(chēng)�����,在對中國1600多個(gè)藥品申請的調查中��,80%的申請應因擔心數據造假或不合格而被撤回���。雖然已采取措施解決2016年提出的問(wèn)題����,但ORIENT-11是在2018年之后不久啟動(dòng)的��,目前尚不清楚2016年報告中包含的任何站點(diǎn)是否涉及ORIENT-11��。先前參與多區域臨床試驗以及與FDA和其他國際監管機構的互動(dòng)為試驗條件提供了信心����。
最終14:1����,信迪利未能獲批���,需要補充試驗���。

早在2017年6月的ASCO(美國臨床腫瘤學(xué)會(huì )年會(huì ))上�����,傳奇生物公布了西達基奧倫塞的早期臨床數據:35例的臨床試驗接近100%的客觀(guān)緩解率�����,數據一出�,舉座皆驚��。2017年12月����,楊森與傳奇生物簽訂了全球獨家許可和合作協(xié)議�����,以開(kāi)發(fā)和商業(yè)化西達基奧倫塞CARVYKTI?��。協(xié)議作價(jià)3.5億美元首付款��,共同研發(fā)和商業(yè)化西達基奧倫塞���;分成方面��,大中華區傳奇生物分七成�����,強生分三成�����,除此之外全球分賬“五五開(kāi)”��。
2021年4月��,傳奇生物宣布向歐洲藥品管理局提交上市許可申請��,以尋求西達基奧倫塞Cilta-cel的獲批�, 用于治療復發(fā)或難治性多發(fā)性骨髓瘤患者���。除2019年12月在美國授予的突破性療法(BTA)外��,西達基奧倫塞Cilta-cel于2020年8月在中國被納入“突破性治療藥物”����。美國FDA和歐洲EMA分別于2019年2月和2020年2月授予西達基奧倫塞Cilta-cel孤兒藥的名稱(chēng)���。
CARTITUDE-1(在美國���、日本����、歐盟開(kāi)展)是一項正在進(jìn)行的1b/2期����、開(kāi)放標簽��、單臂��、多中心的研究���,用于評估CARVYKTI??治療復發(fā)或難治性多發(fā)性骨髓瘤成人患者的安全性和有效性��,這些患者至少接受過(guò)3線(xiàn)前期治療�����,包括蛋白酶體抑制劑(PI)���、免疫調節劑(IMiD)和抗CD38單克隆抗體��。在關(guān)鍵的CARTITUDE-1研究中�����,97例R/R MM患者出現了早期���、深度持久的緩解�,總緩解率(ORR)高達98%(95%CI:92.7-99.7)���,78%的患者獲得了嚴格的完全緩解(sCR�����,95%CI:68.8-86.1)��。在18個(gè)月的中位隨訪(fǎng)時(shí)間中����,中位緩解持續時(shí)間(DOR)為21.8個(gè)月(95% CI����,21.8-無(wú)法預估)����。
傳奇生物主要終點(diǎn)設置為ORR���,與已獲批的Abecma設置標準對應���,相比之下�����,信達生物的信迪利單抗的對照組不符合美國臨床實(shí)踐標準���。
●?差異化的靶點(diǎn)格局和同靶點(diǎn)的設計優(yōu)勢
目前已上市和在研的CAR-T療法在CD19靶點(diǎn)上扎堆較為嚴重����。BCMA次之��,但競爭相對更輕��。西達基奧侖賽含有4-1BB共刺激結構域和兩個(gè)BCMA靶向單域抗體�,旨在增加靶向癌細胞的綜合能力����;與其他同類(lèi)CAR-T產(chǎn)品相比����,西達基奧侖賽不但具有獨特藥物結構��,而且臨床用藥劑量明顯更小��,使用安全性高而療效卻極為優(yōu)異�。
●?面對臨床需求的市場(chǎng)
該產(chǎn)品獲批用于治療既往接受過(guò)蛋白酶體抑制劑��,免疫調節劑和抗CD38抗體的治療方案并在末次治療期間或之后出現疾病進(jìn)展的復發(fā)/難治性多發(fā)性骨髓瘤(r/r MM)成年患者���。目前����,全球范圍內僅BMS子公司藍鳥(niǎo)生物研發(fā)的BCMA靶向CAR-T搶先在2021年3 月末獲批�����,Abecma(ide-cel)首年銷(xiāo)售成績(jì)已經(jīng)出爐�,高達1.64億美元�����,約為同期獲批的CAR-T產(chǎn)品的兩倍之高�����,這也體現了該類(lèi)療法在多發(fā)性骨髓瘤治療領(lǐng)域的潛在前景�����。2021年度�����,在美國已獲批上市的5款CAR-T療法合計銷(xiāo)售額已經(jīng)超過(guò)了15億美元����,且同比增幅均超過(guò)20%����,還將繼續保持高速增長(cháng)�����。相比之下��,PD-1/L1產(chǎn)品在美國已經(jīng)上市多款�����,且信迪利單抗申報的非小細胞肺癌適應癥���,臨床治療方案選擇較為豐富�����。
相比于禮來(lái)僅使用信達中國數據進(jìn)行申報���,傳奇在海外的申報的整個(gè)過(guò)程都有強生的參與甚至是主導�����,在早期就建立了更完成的臨床方案架構�,有更深入的FDA溝通和更充分的準備�����,依托優(yōu)秀的臨床數據�,一舉獲批���。
站在當前時(shí)點(diǎn)�����,中國生物制藥行業(yè)具備了參與全球最高水平競爭的產(chǎn)業(yè)條件����,在模仿過(guò)程中積累know-how�����、申報經(jīng)驗����,培養高素質(zhì)人才���,實(shí)現產(chǎn)業(yè)應用導向創(chuàng )新����,從粗放到精細����,從技術(shù)模仿到制度變革����,從存量廝殺到探索增量空間����,從腫瘤內卷到切實(shí)滿(mǎn)足臨床需求����。
中國創(chuàng )新藥和中國過(guò)往的很多制造業(yè)面臨同樣的情況���,中國創(chuàng )新藥出海不會(huì )一蹴而就��。從歷史的角度看2010年中國首次超過(guò)美國成為制造業(yè)產(chǎn)值全球第一��,2021年上半年����,美國的制造業(yè)產(chǎn)值僅為中國的五成四���,我們在工程師����、市場(chǎng)����、人工���、產(chǎn)業(yè)鏈����、供應鏈上的優(yōu)勢在愈發(fā)系統化的創(chuàng )新藥產(chǎn)業(yè)中依然有不可忽視的優(yōu)勢���。
當下來(lái)看�����,合作開(kāi)發(fā)或者直接售出海外權益的模式是中國biotech公司最佳的道路��,無(wú)論是從臨床資金需求還是和監管溝通上看�����,獨立在歐美開(kāi)展臨床三期和銷(xiāo)售不適合絕大多數中國企業(yè)����。同時(shí)要關(guān)注的是�,雖然FDA有多種途徑對創(chuàng )新藥進(jìn)行加速�,但是這一兩年除了罕見(jiàn)病之外的藥物�,獲批成功率有下降趨勢(包括但是不限于多款BLA前被給予厚望的產(chǎn)品���,例如2021年7月默沙東主動(dòng)撤回PD-1單抗K藥用于胃癌三線(xiàn)的加速審評�����;2021年8月羅氏主動(dòng)撤回PD-L1單抗用于三陰性乳腺癌的加速審評��;2022年1月再生元/賽諾菲主動(dòng)撤回PD-1單抗Libtayo用于鉑類(lèi)耐藥后宮頸癌的上市申請��;同月Incyte因無(wú)法完成驗證性臨床主動(dòng)撤回PI3K抑制劑 Parsaclisib的美國上市申請�����;2022年2月因疑似意外的嚴重不良反應(SUSAR)FDA叫停吉列德CD47單抗Magrolimab的臨床入組)����。因此隨著(zhù)更多藥物獲批上市后�����,對于創(chuàng )新藥尤其是有藥可用的適應癥的藥物��,后續的臨床三期/pivotal的速度���、方案以及未來(lái)BLA成功率要給予更大的安全邊際預估���。
從企業(yè)研發(fā)和資本的角度講�,堅持創(chuàng )新雖然有失敗的風(fēng)險���,但是放棄創(chuàng )新未來(lái)可能更加艱難�。創(chuàng )新本身就是高投入長(cháng)周期的�����,不是短期套利行為�。信達ODAC會(huì )議的失敗和傳奇CART的成功上市其實(shí)也樹(shù)立很好的標準和方向�,未來(lái)投資人和企業(yè)家都要逐步將銷(xiāo)售額���、臨床速度及出海確定性從狂熱的情緒逐漸過(guò)渡至更冷靜��、客觀(guān)的預期�����。過(guò)去想用me-too產(chǎn)品投機的公司�,將評估臨床費用和不菲的申請遞交費用����,真正差異化的產(chǎn)品做全球多中心時(shí)也會(huì )以此為鑒進(jìn)行更規范的操作�。同時(shí)企業(yè)在臨床試驗之初���,要通盤(pán)考慮是否要依靠試驗結果出海�,將來(lái)可能面臨對方審批要求和法規的考察���。
滕宇航�����,高特佳執行合伙人�,擁有生物醫藥理工科和金融類(lèi)復合背景���,熟悉資本運作�����、注重價(jià)值投資�,聚焦大小分子創(chuàng )新藥����、細胞療法�����、基因治療及IVD領(lǐng)域����,對細分行業(yè)發(fā)展趨勢有敏銳判斷�����,擅長(cháng)在企業(yè)發(fā)展早期(A�、B輪)實(shí)現精準布局�����。投資案例包括康方生物(09926)�����、天廣實(shí)生物�����、韜略生物�����、禮進(jìn)生物�����、思康睿奇�、新元素醫藥等����。
2001年高特佳投資在深圳成立�,率先在業(yè)內提出“主題行業(yè)投資”的投資模式����,專(zhuān)注醫療健康產(chǎn)業(yè)投資��,以戰略性股權投資為主導���,投資覆蓋并購��、PE�����、VC���、天使等全階段��。擁有國內規模領(lǐng)先的專(zhuān)業(yè)醫療投資團隊����,構建醫療健康產(chǎn)業(yè)投資生態(tài)平臺�����,致力于成為具有全球影響力的醫療健康投資機構���。
資產(chǎn)管理規模超230億元��,醫療健康產(chǎn)業(yè)基金25支�,先后投資160余家企業(yè)(其中醫療健康企業(yè)90余家)�����,并推動(dòng)了32家企業(yè)成功上市�。
高特佳投資業(yè)務(wù)立足中國�����,面向全球����,在深圳���、上海�、北京����、南京�����、香港等地建立運營(yíng)中心����,致力于在全球范圍內投資優(yōu)秀醫療健康企業(yè)��,為全球資本和醫療企業(yè)嫁接中國動(dòng)力��,協(xié)助創(chuàng )業(yè)者成就偉大企業(yè)���。
