正如該系列第一篇文章“基因治療里的七龍珠”中所提到的��,一款基因治療藥物要想成功面市���,必需經(jīng)過(guò)七大步驟��。從疾病相關(guān)基因的表達調控���,到基因遞送載體的選擇�����,再到藥物上市審批��,每一步都至關(guān)重要����,且極具挑戰性��?����!奥仿湫捱h兮�����,吾將上下而求索”��,在這條收集七龍珠的道路上����,一個(gè)又一個(gè)“孫悟空”為實(shí)現基因治療的理想而努力探索���。本節����,我們將“溯洄從之”����,談一談基因治療的歷史����,看看從基礎技術(shù)積累到基因治療概念的提出���,再到第一例臨床實(shí)驗被批準��,基因治療技術(shù)是如何一步步由理論變?yōu)楝F實(shí)的�����。

▲?圖1.基因治療技術(shù)的發(fā)展脈絡(luò )
1952年���,Joshua Lederberg(約舒亞 · 萊德伯格����,1958年諾貝爾生理學(xué)或醫學(xué)獎獲得者)和Norton Zinder(諾頓 · 津德?tīng)枺┌l(fā)表了名為《Genetic exchange in Salmonella》的文章�����。他們通過(guò)噬菌體將一段鼠傷寒沙門(mén)氏菌的DNA轉移到了另一個(gè)細菌��,從而確定細菌除了轉化和結合外(轉化是指受體菌直接攝取供體菌的DNA片段而獲得新的遺傳性狀的過(guò)程�����;結合是指供體菌和受體菌通過(guò)細胞間的暫時(shí)溝通����,將遺傳物質(zhì)自供體轉入受體���,使受體獲得供體部分遺傳性狀�,由Joshua Lederberg和Tatum在1946年發(fā)現�����。)����,還存在第三種遺傳物質(zhì)的轉移方式:通過(guò)病毒粒子將基因從一種微生物轉移到另一種微生物�,他們稱(chēng)之為“轉導”���。自此人們有了對病毒可以轉移遺傳物質(zhì)的認識�,并很快將其擴展應用到真核生物�,這奠定了病毒作為基因載體工具的基礎��,基因治療中的“長(cháng)征一號”開(kāi)始有了草圖�����。

▲?圖2.普遍性轉導的過(guò)程
在1953年�,生物學(xué)界出現了一個(gè)具有劃時(shí)代意義的發(fā)現:Watson(沃森)和 Crick(克里克)提出了DNA的雙螺旋結構模型����,確定A(腺嘌呤)與T(胸腺嘧啶)配對�����、G(鳥(niǎo)嘌呤)與C(胞嘧啶)配對�����,由此開(kāi)啟了分子生物學(xué)時(shí)代���。在這之后���,DNA半保留復制���、中心法則等相繼被提出����,為基因工程的探索提供了理論依據�,也奠定了基因治療中重要的一環(huán) ——“基因表達與調控”的基礎�����。
1962年�,Waclaw Szybalski(瓦克勞·斯吉巴爾斯基)發(fā)表文章《DNA-mediated heritable transformation of a biochemical trait》���。他通過(guò)在D98S細胞的兩種衍生物HGRPT(+)型細胞和HGRPT(-)型細胞之間進(jìn)行DNA轉導�,并在HAT培養基中篩選����,發(fā)現將HGRPT(+)型的D98S細胞的DNA導入HGRPT(-)型的D98S細胞后��,原本不能在HAT培養基中存活的HGRPT(-)型細胞可以正常存活增值了�。該研究結果成為哺乳動(dòng)物細胞中遺傳基因轉移的第一個(gè)有記錄的證據�,證明遺傳缺陷可以通過(guò)外源的DNA來(lái)修復�����。為基因治療提供了進(jìn)一步的理論基礎���。
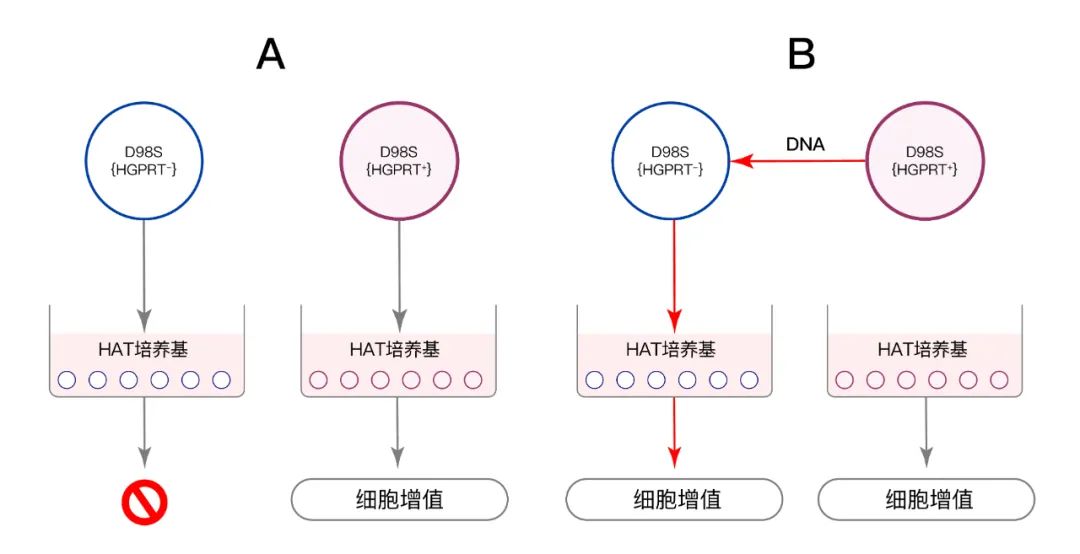
▲?圖3.D98S細胞的遺傳基因轉移實(shí)驗
在生物學(xué)領(lǐng)域新發(fā)現���、新事物層出不窮的背景下��,Edward Tatum(愛(ài)德華·塔特姆)和Joshua Lederberg在1963年提出可利用病毒作為基因轉移載體�����,進(jìn)行細胞的基因交換和基因優(yōu)化�。
1966年���,Edward Tatum在《Molecular biology, nucleic acids, and the future of medicine》中寫(xiě)道:“These will come by epidemiological, immunological, and chemotherapeutic means, by modification and regulation of gene activities, orby means of?gene repair or replacement.”�����。預測基因修復和替代將在疾病治療中有極大的前途和作用��。并且提到����,在關(guān)鍵酶�����、基因編碼以及合適的方法確立后�,基因就可以在體外有序的合成��。再加上已有的DNA攝取和整合技術(shù)�,基因工程的實(shí)現便指日可待了�!
但是此時(shí)這只是科學(xué)家們暢想的美好藍圖�����,就連Gene Therapy這個(gè)名詞都還沒(méi)有出現���,顯然在技術(shù)積累上還需要繼續蓄力����。正如最初的電子計算機ENIAC(埃尼阿克)發(fā)展成如今的電腦���,需要有更多的關(guān)鍵性新技術(shù)和新工具出現����。
迷途中實(shí)踐-第一個(gè)吃螃蟹的人
1968年���,Stanfield Rogers(斯坦菲爾德· 羅杰斯)等人用TMV(煙草花葉病毒)作為載體����,將聚腺苷酸延伸到病毒RNA上�,首次證明了經(jīng)過(guò)人工修飾的基因可以通過(guò)病毒載體來(lái)介導其轉移�����。在這一結果的基礎上��,他于1970年進(jìn)行了第一次人體基因治療試驗�����。之前已有研究發(fā)現�,兔感染SPV(肖普乳頭狀瘤病毒)可以使其皮膚長(cháng)出肉疣�����,體內會(huì )生成精氨酸酶�,導致兔血清中精氨酸水平下降��。所以他們推測SPV攜帶編碼精氨酸酶的基因���,于是他們嘗試通過(guò)體內注射野生型SPV來(lái)治療兩個(gè)患有精氨酸酶缺乏癥的女孩��。但是不幸的是�����,試驗的結果是陰性的�,患者血清精氨酸水平并未監測到明顯變化�����。后來(lái)����,在對SPV基因組進(jìn)行測序后�,發(fā)現SPV基因組實(shí)際上并不編碼精氨酸酶��。此次試驗是在對患者基因型�����、病毒載體特性等方面都不清楚的情況下進(jìn)行的�����,更不存在藥品監管部門(mén)的審批�,不得不說(shuō)是非常大膽且危險的行為����,幸而沒(méi)有對患者造成更多的傷害�。但從中不難看出患者對治療藥物迫切的需求以及科學(xué)家對基因治療積極的探索����,只是原理還沒(méi)有清晰����,尤其是對基因表達及調控的復雜程度缺乏清晰的認知���,技術(shù)還遠不成熟�����,倫理監管仍需嚴格把關(guān)�����。
快還是慢- Gene Therapy如何抉擇
20世紀七八十年代是基因工程飛速發(fā)展的階段��,一系列與基因修飾和合成相關(guān)的酶被發(fā)現:包括限制性?xún)惹忻?��、DNA連接酶和逆轉錄酶等�。這些酶的發(fā)現促成了第一個(gè)重組DNA分子的產(chǎn)生����,促成了在大腸桿菌體內表達葡萄球菌乃至哺乳動(dòng)物的基因�,同時(shí)也為病毒載體介導的基因治療技術(shù)發(fā)展帶來(lái)了信心����。所有人都在熱切盼望技術(shù)成功的那一天�。
“Gene Therapy for Human Genetic Disease? ”Theodore Friedmann(西奧多·弗里德曼) 1972年在 Science 上發(fā)表了一篇評論��,第一次提出了基因治療的概念���,同時(shí)也表達了對基因治療未來(lái)發(fā)展的憧憬和擔憂(yōu)���。在當時(shí)�,已知由基因缺陷導致的遺傳病就有1500多種�,而且大部分是罕見(jiàn)病����,他們面對的是更少的研究投入和更渺茫的治愈可能���。用外源的“good”基因代替有缺陷的基因��,通過(guò)基因治療的手段去治療疾病����,將給這些患者帶來(lái)福音�。然而�,雖然基因治療的概念藍圖早已被畫(huà)出�,但是病毒載體的修飾����、基因表達的調控(靶向性���,整合效率等)���、免疫原性等問(wèn)題都是不得不去思考和重視的關(guān)鍵因素���。他提倡建立倫理-科學(xué)的標準��,來(lái)規范和約束大家的激進(jìn)嘗試:(1)清楚疾病發(fā)生原因�;(2)考慮病人的異質(zhì)性���,看似癥狀相同的遺傳疾病在不同的個(gè)體中具有不同的遺傳方式��;(3)外源性DNA載體質(zhì)量和安全性保證��;(4)在實(shí)驗動(dòng)物上進(jìn)行廣泛的研究�;(5)對于某些遺傳性疾病��,先利用體外培養的患者皮膚成纖維細胞做測試��?����;蛑委熥罱K目標是盡可能實(shí)現患者的利益�,使用之前要充分評估其風(fēng)險�����,因此病因和治療機制必須明確�����,不成熟地應用不被充分理解的技術(shù)����,會(huì )造成嚴重的后果����?���?傊畟惱淼囊幏?、科學(xué)的依據才是基因治療實(shí)現應用的前提�。
快就是慢- 一次失敗的實(shí)驗
1979年�����, Martin Cline(馬丁·克萊因)利用磷酸鈣轉染的方式��,成功將人免疫球蛋白基因導入小鼠的骨髓細胞�,用于免疫球蛋白基因缺陷小鼠的治療��。除此之外����,他還將外源基因(二氫葉酸還原酶和單純皰疹病毒胸苷激酶)導入小鼠骨髓干細胞�����,而這些修飾過(guò)的細胞能夠在其他小鼠的骨髓中部分再生����。受到這些結果的鼓舞���,1980年Martin Cline打算在病人身上測試這種治療方法�����,他向UCLA (加州大學(xué)洛杉磯分校)申請使用同樣的方法治療β-地中海貧血患者�����。在本系列之前的文章中已經(jīng)提到過(guò)��,β-地中海貧血是由于血紅蛋白中β –珠蛋白的缺失(缺陷)造成的�����,通常會(huì )導致嚴重的甚至危及生命的貧血���,當時(shí)對此唯一的治療方案是依賴(lài)于頻繁輸血�。之所以選擇地中海貧血是由于人們對它的研究較多�,以為其發(fā)病機制已比較清楚(實(shí)際上地貧的病因和治療極其復雜)���。然而����,他的申請并沒(méi)有得到審查委員會(huì )的許可�����,但是他還是啟動(dòng)了這項研究�!從兩名β-地中海貧血重癥患者身上抽取了骨髓細胞�,并對其進(jìn)行改造和回輸����,一名患者在意大利接受治療���,另一名在以色列接受治療�����。但是很可惜這次試驗因為沒(méi)有使患者的臨床癥狀得到緩解而宣告失敗����,Martin Cline也因開(kāi)展未經(jīng)批準的人體實(shí)驗受到了嚴厲處罰和廣泛指責���。這次試驗是第一次嘗試利用重組DNA進(jìn)行基因治療����,雖然已經(jīng)意識到對細胞進(jìn)行基因修飾在基因治療中的重要性����,但顯然低估了其復雜性�����。此次事件后�����,體細胞基因治療一度受到冷落���。
進(jìn)入春天-?監管下的基因治療
直到1988年12月�,RAC (重組DNA咨詢(xún)委員會(huì )) 正式批準了Steven Rosenberg(史蒂文 ? 羅森伯格)關(guān)于將外源基因導入人體的臨床方案����。在之前的研究中����,Rosenberg發(fā)現通過(guò) TILs (腫瘤浸潤性淋巴細胞)和白介素-2可以治療轉移性黑色素瘤��,于是他從轉移性黑色素瘤患者身上提取了TILs��,并利用逆轉錄病毒作為載體對其進(jìn)行了抗性標記���,想要探究TILs浸潤和它們對腫瘤治療的有效性之間是否存在臨床相關(guān)性����。后來(lái)再看����,這次試驗僅是用一個(gè)報告基因構建的表達載體����,了解標記基因在人體內的分布和表達情況��,可以看作一個(gè)基因治療對照實(shí)驗��,并不是真正的基因治療�����。
1990年���,史上最早被正式批準的基因治療人體試驗開(kāi)始了����。William French Anderson(威廉·弗蘭奇·安德森)醫生領(lǐng)銜開(kāi)展了針對重癥聯(lián)合免疫缺陷?��。⊿CID)的基因治療���。SCID是由ADA(腺苷脫氨酶)缺陷或白介素受體(IL-2R最常見(jiàn))功能障礙所致�����。ADA-SCID為常染色體隱性遺傳病�����,兩條染色體上的ADA基因都發(fā)生了突變���,導致ADA蛋白缺失�����,從而引起細胞損傷或死亡��,致細胞體液免疫缺陷���,人體內的免疫T細胞會(huì )很快死去��,這相當于身體對細菌和病毒開(kāi)放��,非常危險����。兩名ADA-SCID的患病兒童接受了此次基因治療���,研究人員從患兒血液中提取了白細胞����,并在體外利用逆轉錄病毒載體將能夠正確編碼ADA的基因插入患者的白細胞基因組中���,然后進(jìn)行白細胞回輸����。之后的檢測表明��, 其中一位受試者Ashanti DeSilva(阿莎提·德席爾瓦)體內的白細胞確實(shí)可以正確地合成ADA了�����,在6個(gè)月后她的T細胞水平便恢復了正常值���。盡管這種藥物顯著(zhù)減輕了Ashanti的癥狀���,但是并沒(méi)有完全治愈她��,直到現在她仍需定期接受 PEG-ADA (聚乙二醇腺嘌呤脫氨酶)的替代治療�����,因此人們對本次基因治療的效果仍存在一些爭議���。但無(wú)論如何這次試驗意義重大�,是一個(gè)典型的成功案例���,也讓基因治療正式走進(jìn)了普通大眾的視野�����,基因治療在理論����、技術(shù)�����、政策上全面的進(jìn)入了春天�����。
▲?圖4.?Anderson醫生和Ashanti
60年代到90年代��,從提出基因優(yōu)化的概念到第一例臨床實(shí)驗的審批����,短短三十年的時(shí)間���,基因治療便從理論走向現實(shí)��;而后從1990年直到現在�,又是三十年過(guò)去了����,后續的研究應用又是如何站在巨人的肩膀上昂首向前的���?基因治療“道阻且長(cháng)”����,但我們充滿(mǎn)期待與信心��,且看下回再與您共同回顧�!
【參考文獻】:
?Buchanan,B.G. Joshua Lederberg (1925-2008); 2008.
?DunbarCE, High KA, Joung JK, Kohn DB, Ozawa K, Sadelain M. Gene therapycomes of age.?Science?2018; 359(6372):eaan4672.
FriedmannT, Roblin R. Gene Therapy for Human Genetic Disease??Science?1972;175(4025): 949-955.
MedicineIO. Microbial Evolution and Co-Adaptation: A Tribute to the Life and ScientificLegacies of Joshua Lederberg: Workshop Summary. 2009.
ShahryariA, Saghaeian Jazi M, Mohammadi S, Razavi Nikoo H, Nazari Z, Hosseini ES,?et al. Development and Clinical Translation of Approved Gene Therapy Productsfor Genetic Disorders.?Front Genet?2019; 10:868.
SzybalskiSW. GENETICS OF HUMAN CELL LINES, IV. DNA-MEDIATEDHERITABLE TRANSFORMATION OF A BIOCHEMICAL TRAIT.?Proceedings of theNational Academy of Sciences of the United States of America?1962��;48 (12)?:2026-2034.
WirthT, Parker N, Yla-Herttuala S. History of?gene?therapy.?Gene?2013;525(2): 162-169.