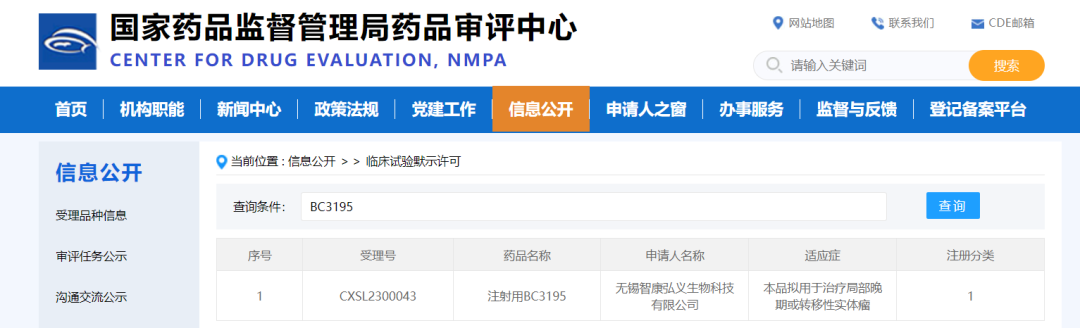
近日�����,智康弘義發(fā)布新聞稿稱(chēng)���,其全球獨家開(kāi)發(fā)的新一代靶向CDH3的抗體偶聯(lián)藥物(ADC)BC3195通過(guò)國家藥品監管管理局(NMPA)臨床默示許可����,擬用于治療局部晚期或轉移性實(shí)體瘤���。
根據智康弘義新聞稿介紹���,BC3195全新靶向的CDH3蛋白在多種惡性實(shí)體腫瘤(如肺癌和乳腺癌等)中特異性高表達��,是理想的�、具有高度潛力的可針對多種惡性實(shí)體腫瘤的ADC靶點(diǎn)�。
作為一款最新一代全球獨家靶向CDH3靶點(diǎn)的ADC產(chǎn)品�,BC3195的優(yōu)勢之一在于采用高度差異化的抗體設計���,抗體與CDH3蛋白具有較高的親和力����,同時(shí)展現出非常出色的內吞活性����;BC3195的另一優(yōu)勢在于策略性的采用經(jīng)臨床驗證的連接子和具有“旁觀(guān)者效應”的有效載荷vcMMAE�,極大的提高了臨床開(kāi)發(fā)的可靠性�����。BC3195在臨床前研究中表現出優(yōu)異的腫瘤抑制活性����,在多個(gè)腫瘤模型中的腫瘤生長(cháng)抑制率大于100%����。
BC3195已于今年2月獲批美國臨床����,智康弘義計劃在中美同步開(kāi)展BC3195的 I 期臨床研究��,廣東省人民醫院的吳一龍教授將擔任本臨床試驗的主要研究者�,來(lái)自美國紀念斯隆-凱特琳癌癥中心(MSKCC)的腫瘤內科專(zhuān)家Bob Li教授將負責在美開(kāi)展的臨床試驗�����。
聯(lián)系方式:ir@biocitypharma.com
往期推薦:
智康弘義——WEE1激酶小分子抑制劑SC0191獲批美國 I/II 臨床�����,擬單藥和聯(lián)合化療用于治療晚期實(shí)體瘤 | 項目進(jìn)展
智康弘義——全球首創(chuàng )新一代靶向CDH3的抗體偶聯(lián)藥物(ADC)獲批美國臨床 | 項目進(jìn)展
智康弘義——TIM-3單抗BC3402注射液在中美分別獲l期�、Ib/II期臨床試驗批準�����,擬用于治療惡性血液疾病 | 項目進(jìn)展