日前����,位于美國新澤西州的 Ascendia Pharma 宣布其 ACD-002 改良性新藥氯吡格雷納米乳注射劑上月向 FDA 提交了 IND 申請���,目前該方案已獲得 FDA 的書(shū)面批準���。
硫酸氫氯吡格雷是賽諾菲和百時(shí)美聯(lián)合開(kāi)發(fā)的第二代 P2Y12 受體抑制劑類(lèi)抗血小板藥物�, 1998 年 6 月首次在美國上市��,上市后第四年就成為重磅炸彈藥物��,并于 2009 年達近百億美元的市場(chǎng)巔峰��。氯吡格雷低劑量(75 毫克/天)被廣泛應用于 PCI 手術(shù)后的長(cháng)期抗血栓治療�,負荷劑量(300-600mg/次)被應用于 PCI 手術(shù)的術(shù)前預處理����,以降低 PCI 手術(shù)患者的心血管風(fēng)險�����。
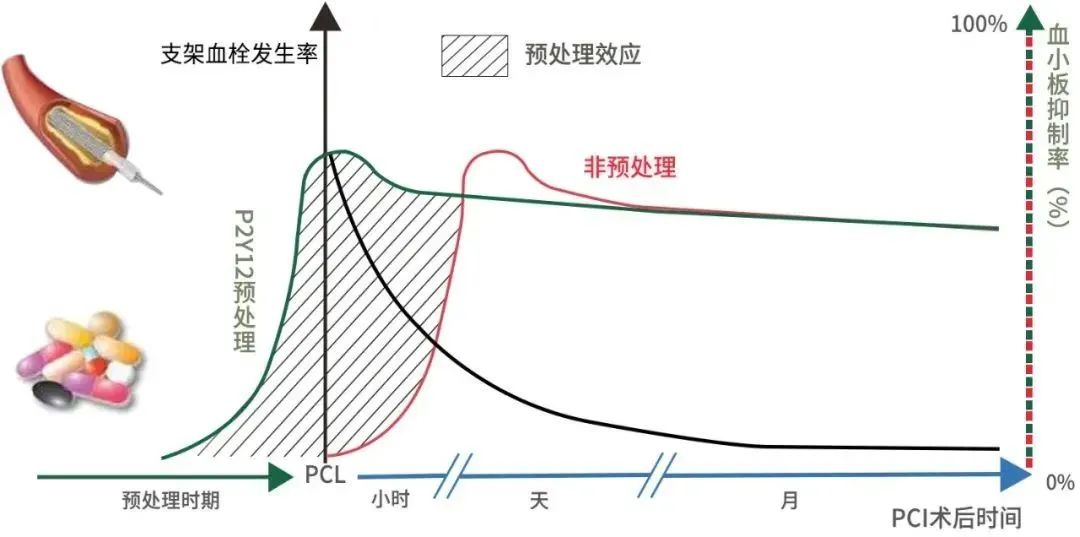
氯吡格雷至今僅有口服片劑上市�,對于急診手術(shù)患者的用藥存在很大的局限性�。氯吡格雷在體外為無(wú)活性的前體藥物�,形態(tài)是具有高粘度流動(dòng)性的半固體形式����,不利于貯存或處理加工����,且溶解度具有很強的 PH 依賴(lài)性��,其口服制劑是以硫酸氫鹽形式存在�����。特殊的理化性質(zhì)�����,導致開(kāi)發(fā)氯吡格雷注射劑的難度非常之大����,包括賽諾菲公司在內的多家藥企都曾嘗試將氯吡格雷改為注射劑����,均未成功�。
Ascendia Pharma 通過(guò)近十年的不懈努力��,采用特殊的納米乳專(zhuān)利技術(shù)( EmulSol ), 成功研發(fā)出高載藥量��、穩定����、即時(shí)可用的氯吡格雷注射劑��。這是迄今為止全球第一個(gè)進(jìn)入臨床的氯吡格雷注射劑�。值得注意的是�,在早先進(jìn)行的 Pre-IND 會(huì )議上���,FDA 已經(jīng)認可 ACD-002 作為 505(b)2 產(chǎn)品�,將可以通過(guò)規?�?煽氐呐R床試驗�,快速獲得 FDA 批準上市���。
2023 年 4 月 25 日剛剛結束的第二十六屆中國介入心臟病論壇暨第十二屆胸痛中心大會(huì )(CCIF&CCPCC 2023)����,公布了 2022 年中國 PCI 手術(shù)的數量已經(jīng)突破 129 萬(wàn)例(不含部隊醫院)�����,年增長(cháng)率 11%���。盡管如此���,相比美國 3 億人口���、95 萬(wàn)例/年的數量�,中國 PCI 數量仍有有非常大的增長(cháng)空間����。同時(shí)根據 2019 年 11 月 9 日發(fā)表在《美國心血管雜志 JAHA》上的研究報告顯示���,中國的急診 PCI 占比為 32.88%��,與美國(65.98%)有不小的差距���。近年來(lái)由于藥品和冠脈支架的集采降價(jià)��,大大提高了 PCI 手術(shù)的可及性����,此外隨著(zhù)各地胸痛中心的建設普及��,急診處置水平也得以大幅度提升��。預計未來(lái) PCI 的數量將持續增長(cháng)���,急診比例也將進(jìn)一步提高�。如何進(jìn)一步減少急診 PCI 手術(shù)患者的心血管風(fēng)險��,是一個(gè)迫在眉睫的未滿(mǎn)足臨床需求�。
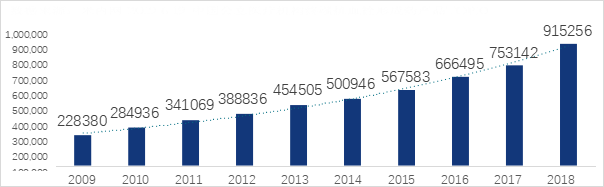
數據來(lái)源:CCIF
2020 年 10 月����,位于蘇州吳中生物醫藥產(chǎn)業(yè)園的 Lindmik Pharma 樂(lè )明藥業(yè)(蘇州)有限公司與 Ascendia Pharm 達成了合作協(xié)議��,獲得了氯吡格雷納米乳注射劑的中國權益����,并將獲得授權成為全球的生產(chǎn)中心���,樂(lè )明藥業(yè)將同步啟動(dòng)中國的申報工作�����。據悉樂(lè )明藥業(yè)是一家專(zhuān)注復雜制劑的研發(fā)生產(chǎn)企業(yè)�,已有兩款重磅經(jīng)皮給藥產(chǎn)品率先進(jìn)入上市申請階段�。

氯吡格雷納米注射劑 IND 獲得批準���,是一個(gè)令人鼓舞的消息��,如果能順利獲批����,將大大降低急診 PCI 手術(shù)患者的心血管事件風(fēng)險�,多位國內知名心血管領(lǐng)域專(zhuān)家表達了對產(chǎn)品獲批的期待����。