FDA批準采用更具臨床意義與挑戰的主要研究終點(diǎn)評價(jià)普那布林106三期優(yōu)效臨床研究
萬(wàn)春醫藥(納斯達克:BYSI)宣布����,美國食品和藥物管理局(FDA)同意采用新的主要研究終點(diǎn)��,用于First-in-class藥物普那布林在106 phase III臨床試驗的有效性評估(普那布林+Neulasta vs. Neulasta)���。
普那布林是一款具有全新作用機制的在研全新小分子免疫調節藥物�,目前在三期臨床階段����,其中一個(gè)重要方向是用于治療由化療引起的中性粒細胞減少癥(CIN)���。前期的臨床研究數據表明���,與G-CSF相比普那布林可以快速起效�,在前8天有效保護白細胞��。萬(wàn)春醫藥的研發(fā)團隊經(jīng)過(guò)與FDA的深入溝通�,二期研究結果獲得高度認可��,本次向FDA遞交的全新的主要研究終點(diǎn)是:“在第一個(gè)化療周期中未發(fā)生4級中性粒細胞減少癥患者的百分比”���。這與CIN非劣性研究既往以中性粒細胞減少癥的持續時(shí)間(DSN)作為主要終點(diǎn)相比�,可以更加清晰的評價(jià)普那布林在治療CIN中發(fā)揮的關(guān)鍵作用�����,更加充分體現其在真實(shí)世界中的臨床意義與治療突破性���。而且�����,萬(wàn)春還會(huì )給FDA提供一個(gè)非常詳細的計劃�����,通過(guò)106試驗證明這個(gè)新終點(diǎn)的臨床意義�。
盡管酪氨酸激酶抑制劑(TKIs)和PD-1/PD-L1抑制劑等為腫瘤治療提供了全新的手段��,但是化療依然是腫瘤治療的主要方法��,并且在免疫治療時(shí)代仍然占據著(zhù)重要角色����。事實(shí)上避免患者在接受化療時(shí)發(fā)生四級中性粒細胞減少癥至關(guān)重要�,多個(gè)文獻證明:一旦出現將意味著(zhù)患者發(fā)生感染���、重度白細胞減少癥伴發(fā)熱(FN)����、緊急住院����、菌血癥�、死亡或危及生命的并發(fā)癥的比例極高��;而如果沒(méi)有出現����,則相關(guān)風(fēng)險大大降低�����。近30年來(lái)��,臨床上最常用的預防和治療中性粒細胞減少癥的藥物是G-CSF或者(PEG)G-CSF��,但此類(lèi)藥物并不能滿(mǎn)足全部的治療需求���。在萬(wàn)春醫藥的106 II期 臨床研究中����,選擇的是經(jīng)治療乳腺癌的TAC(多西他賽+阿霉素+環(huán)磷酰胺)方案引起的CIN��。TAC的選擇是作為高風(fēng)險化療的代表�����,美國所有的批準的生物等效的G-CSF����,(PEG)G-CSF都是用TAC作為高風(fēng)險化療的代表�。普那布林20mg/m2聯(lián)合Neulasta 6mg組在該項研究中保護了62.5%的患者未出現4級中性粒細胞減少癥(即37.5%的患者發(fā)生了4級CIN)��,而Neulasta單藥組(當前的標準療法)的保護率為40.9%(即59.1%的患者發(fā)生了4級CIN)��。治療組將風(fēng)險降低了53%�,證明了普那布林聯(lián)合Neulasta治療與Neulasta單藥相較的優(yōu)越性��。
106二期試驗:TAC, 乳腺癌�,第1周期前15天的ANC (中性粒細胞的中位數)
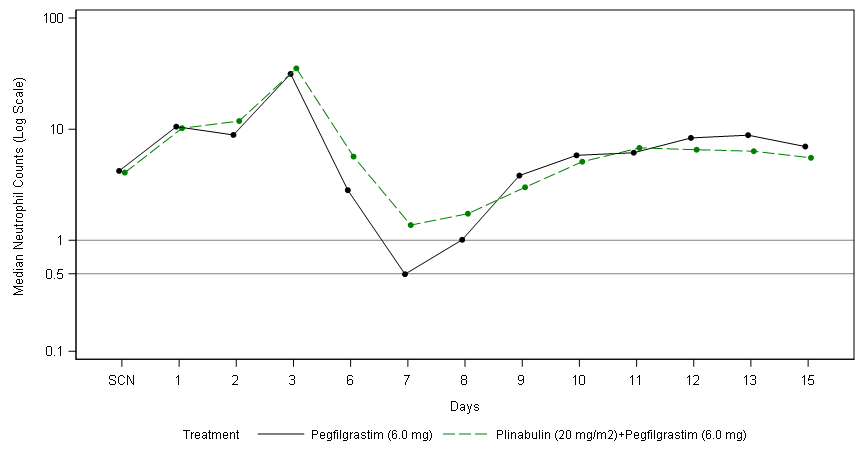
究其原因����,普那布林同時(shí)作用于延遲中性粒細胞凋亡與加速中性粒細胞成熟�����,具有快速起效機制���,在第一個(gè)化療周期的第1天到第8天可以起到保護作用����;而Neulasta的作用是促進(jìn)中性粒細胞成熟����,通常從第8天后才開(kāi)始白細胞生成����。在106二期試驗中��,任何普那布林組(n=93)在第1天至第8天未發(fā)生4級中性粒細胞減少癥的患者比例為68.8%���,而Neulasta 6 mg組(n=22)未發(fā)生患者比例為40.9%(p=0.0149)�?����;谒鼈兊幕パa作用機制��,將這兩種治療手段充分結合�,可以為化療患者提供最大化的臨床保護����,確?���;颊咄瓿芍委煵⒆罱K獲益���。另外��,普那布林本身也具有激活成熟樹(shù)突狀DC細胞為核心機理的抗腫瘤作用(“Chem” and “Cell Reports”���,2019)�,在萬(wàn)春醫藥的另外一項國際多中心III期臨床試驗--普那布林聯(lián)合多西他賽對比多西他賽單藥治療既往全身治療失敗的EGFR野生型非小細胞肺癌患者的臨床研究也接近尾聲�����。普那布林作為一個(gè)同時(shí)具有治療CIN以及抗腫瘤作用的小分子藥物���,未來(lái)的市場(chǎng)應用前景將極其廣闊�。“與G-CSF相比��,這一新的主要終點(diǎn)更能體現準確優(yōu)效預防CIN的臨床獲益���。新的終點(diǎn)不僅比之前采用DSN做為主要研究終點(diǎn)具有更大的動(dòng)態(tài)范圍����,而且明顯具有更重要的臨床相關(guān)性���。這標志著(zhù)一個(gè)新的以患者為中心的嚴重CIN治療時(shí)代的開(kāi)始���,我希望這一新的主要終點(diǎn)成為新的治療評價(jià)標準��?�!盌ouglas W. Blayney教授評論道�����,他是普那布林CIN研究的全球首席研究員和斯坦福醫學(xué)院的醫學(xué)教授���,也曾是美國FDA癌癥藥物審查委員會(huì )(ODAC)成員�。
萬(wàn)春醫藥的聯(lián)合創(chuàng )始人����、董事長(cháng)兼首席執行官黃嵐博士則評論道:“三十年來(lái)�,CIN治療標準一直在演變��,30年前是用FN(發(fā)熱+感染)�����,是Neupogen對照空白的試驗��,然后20年前用DSN(中性粒細胞減少癥的持續時(shí)間)衡量G-CSF仿制藥對照G-CSF的療效的非劣性試驗����,這次遞交的新的CIN主要研究終點(diǎn)能更好地反映臨床意義��,更敏感�、準確來(lái)衡量對CIN給予更全面的保護�����,是專(zhuān)門(mén)為優(yōu)效研究設立的���。由于CIN是導致化療劑量和化療方案調整的主要原因�����,普那布林與(PEG)G-CSF聯(lián)合使更多的癌癥病人用最佳的化療方案和劑量��,不降劑量�����,這樣為患者提供更好的生活質(zhì)量���,并優(yōu)化化療的治療格局����?��!?/span>

關(guān)于萬(wàn)春醫藥
萬(wàn)春醫藥是一家全球性致力于研發(fā)新型腫瘤免疫療法的生物技術(shù)公司��,現正在研發(fā)創(chuàng )新抗腫瘤免疫療法�����。萬(wàn)春醫藥的核心資產(chǎn)���,作為免疫和干細胞調節劑的First-in-class藥物普那布林���,其兩個(gè)適應癥目前正處于全球III期臨床試驗階段�,其中一個(gè)是治療非小細胞肺癌(NSCLC)��,另一個(gè)是預防化療引起的重度中性粒細胞減少癥(CIN)�����。萬(wàn)春醫藥擁有強大的研發(fā)產(chǎn)品管線(xiàn)����,包括普那布林�,三項自主研發(fā)的新型癌癥藥物和一項使用泛素化降解途徑的新藥研發(fā)平臺�����。公司還擁有一支經(jīng)驗豐富的管理團隊���,擁有多年將創(chuàng )新藥物推向全球市場(chǎng)的經(jīng)驗�����。
關(guān)于普那布林
普那布林是全新小分子����,它是一種分化免疫和干細胞調節劑��。普那布林聯(lián)合多西他賽治療非小細胞肺癌以及預防化療引起的重度中性粒細胞減少癥的臨床研究已臨近尾聲���。普那布林持久的抗癌作用與其作為一種有效的抗原提呈細胞(APC)誘導劑(通過(guò)激活樹(shù)突狀細胞成熟)和T細胞活化作用有關(guān)�����。普那布林的CIN數據強調了其提高小鼠造血干/祖細胞(HSPCs)或譜系-/cKit+/Sca1+(LSK)細胞數量的能力�����。對HSPCs的影響可以解釋普那布林為何不僅可以治療CIN�,而且可以改善化療引起的血小板減少�����,增加循環(huán)CD34+細胞�����。
關(guān)于普那布林在CIN方面的相關(guān)研究:?????
105 III期研究和106 III期研究都是全球多中心��、雙盲的3期臨床試驗��,以支持普那布林治療CIN(適用于所有化療����,和所有腫瘤)的應用�����。??
???? ? ?
105 III期研究旨在評價(jià)多西他賽聯(lián)合普那布林(40mg�����,第1天給藥)對比多西他賽聯(lián)合Neulasta(6mg��,第2天給藥)在治療非小細胞肺癌���、乳腺癌和前列腺癌患者的安全性和有效性非劣效性研究����,其中多西紫杉醇是中等風(fēng)險化療的代表����。
106 III期研究旨在評估普那布林聯(lián)合Neulasta對比Neulasta單藥在TAC方案(多西他賽�����、阿霉素和環(huán)磷酰胺)治療乳腺癌患者的安全性和有效性研究�����,在21天的周期內��,分別使用普那布林(40 mg�,第1天給藥)+ Neulasta(6 mg���,第2天給藥)對比單藥Neulasta(6 mg�,第2天給藥)����。TAC是高風(fēng)險化療的代表���,而普那布林和G-CSF在預防CIN中具有互補作用��。在106II期研究中�,聯(lián)合用藥組顯示出在CIN治療中更好的療效�����。
不同文獻顯示���,TAC和Neulasta 6mg的4級中性粒細胞減少率為83%至93%��,這表明嚴重的醫療需求未得到滿(mǎn)足 [Masuda N et al, Supportive Care Cancer 23: 2891-2898 (2015); Lee Jet al., Annals of Surgical Treatment and Research 94 (5): 223-238 (2018)]���。